| 水的组成 |
主编:黄冈中学化学集体备课组
【复习】前面学习的内容
【引入】从同学们熟悉的水的性质引入新课
一、水的电解实验
1、实验装置:
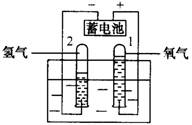
2、实验现象:通电后,电极上有气泡产生,一段时间后,与负极相连的试管和与正极相连的试管所收集到的气体的体积比约为2:1。(负多正少)
3、检验气体:体积小的气体能使带火星的木条复燃,说明是氧气;体积大的气体移近火焰时,气体能燃烧产生淡蓝色火焰,说明是氢气。(负氢正氧)
4、实验结论:水(H2O)在通电条件下,发生分解反应,产生氢气(H2)和氧气(O2)。说明水是由氢元素和氧元素组成的。
文字表达式为:水
氢气 + 氧气
(H2O) (H2) (O2)
注意:向水中加入适量的稀硫酸或氢氧化钠的作用是:增强水溶液的导电性。
5、误差分析
与负极相连的试管和与正极相连的试管所收集到的气体的体积比大于2:1的原因:
①氧气在水中的溶解性大于氢气;
②氧气可能与电极等物质反应了一部分。
6、氢气的检验:将气体移近火焰,如果气体能燃烧产生淡蓝色火焰,说明是氢气。
氢气在空气中燃烧的文字表达式为:氢气+氧气
水
7、氢气的验纯方法:用排水法或向下排空气法收集氢气,用大拇指堵住试管口,管口向下,移近火焰,移开大拇指点火。若发出尖锐的爆鸣声,表明氢气不纯;若声音很小,表明氢气较纯。
二、水的物理性质
水是无色、无味的液体。在4℃时,水的密度最大,为1g/mL。在101kPa下,水的凝固点为0℃ (冰点),沸点是100℃。冰的密度比水的密度小。水的导电能力较弱。
【过渡】氢气(H2)、氧气(O2) 、水(H2O)从组成上看,有何不同?
三、单质、化合物、氧化物
氧化物:由两种元素组成,其中一种元素是氧元素的化合物。如:水(H2O)、二氧化碳(CO2)
注意:纯净物分为单质和化合物,氧化物是化合物中的一部分。
练习:写出一些物质的化学式,请学生判断物质类别:
(1)氧化镁(MgO):(纯净物、化合物、氧化物)
(2)水(H2O) :(纯净物、化合物、氧化物)
(3)冰水混合物:(纯净物、化合物、氧化物)
(4)二氧化碳(CO2) :(纯净物、化合物、氧化物)
(5)高锰酸钾(KMnO4) :(纯净物、化合物)
(6)氧气(O2)和臭氧(O3)的混合物:(混合物)
【总结】
1、水的组成
(1)电解水的实验
(2)水的组成:水是由氢元素和氧元素组成的。
文字表达式为:水
氢气 + 氧气
(H2O) (H2) (O2)
2、单质、化合物、氧化物
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -

