| 离子(1) |
主编:黄冈中学化学集体备课组
一、核外电子的分层排布
1、电子层
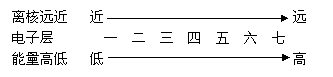
2、原子结构示意图

【讲解】
(1)m决定元素种类;
(2)n与元素的化学性质关系密切;
(3)m=2+8+n;
(4)在化学反应中,n可变,m不可变。
3、核外电子的排布规律(1~18号元素)
(1)电子总是优先排在能量较低的电子层,即排满第一层排第二层,排满第二层排第三层。
(2)每个电子层最多容纳的电子数为2n2(n为电子层数),即第一层最多容纳2个电子,第二层最多容纳8个电子。
(3)最外层电子数不超过8个(第一层为最外层时,不超过2个)。
【练习】画出1-18号元素的原子结构示意图
【通过原子结构示意图总结】
4、相对稳定结构
最外层具有8个电子(只有1层时具有2个电子)的结构称为相对稳定结构
5、原子结构与元素化学性质的关系(一般最外层电子数决定元素的化学性质)
元素分类
最外层电子数
结构的稳定性
化学竹质
金属元素
一般<4(较少)
不稳定
易失最外层电子,达到稳定结构
非金属元素
一般>4(较多)
不稳定
易得电子,达到稳定结构
稀有气体元素
8(He为2)
稳定
难得失电子
说明:
(1)元素的化学性质与最外层电子数相关。
(2)化学反应中,原子核不变,核外电子数可能发生改变。
(3)金属元素、非金属元素最外层电子数有的有4个电子,所以上表中规律有局限性。
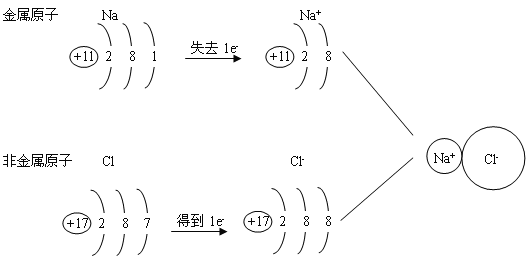
二、离子
【讲解】
1、定义:带电荷的原子(或原子团)叫做离子,如Na+、Cl-、SO42-等。
2、离子的分类
阳离子:带正电荷的原子(或原子团),如Na+、Mg2+、NH4+
阴离子:带负电荷的原子(或原子团),如Cl-、S2-、SO42-
【总结】
一、核外电子的分层排布
1、电子层
2、原子结构示意图
3、核外电子的排布规律(1~18号元素)
4、相对稳定结构
5、原子结构与元素化学性质的关系(一般最外层电子数决定元素的化学性质)
二、离子
1、定义:带电荷的原子(或原子团)叫做离子,如Na+、Cl-、SO42-等。
2、离子的分类
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -