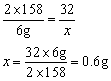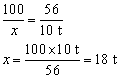| 利用化学方程式的简单计算(1) |
主编:黄冈中学化学集体备课组
【复习】化学方程式的意义
1、表示反应物、生成物以及反应条件。
2、表示反应物、生成物之间的质量关系(即质量比)。
3、反应物、生成物的各粒子的相对数量关系。
例如:C+O2
CO2
(1)质的方面:碳与氧气在点燃的条件下生成二氧化碳。
(2)量的方而:每12份质量的碳跟32份质量的氧气完全反应生成44份质量的二氧化碳。
(3)粒子方面:1个碳原子与1个氧气分子反应生成1个二氧化碳分子。
【引入】根据化学方程式的意义可进行化学方程式的简单计算
例1、加热分解6g高锰酸钾,可以得到多少克氧气?
解:
(1)设未知量
(2)写出反应的化学方程式并配平
(3)写出相关物质的相对分子质量和已知量、未知量
(4)列出比例式,求解
(5)简明地写出答案
设:
加热分解6g高锰酸钾可以得到氧气的质量为x。
2KMnO4
K2MnO4+MnO2 +O2↑
316 32
6g x
答:加热分解6g高锰酸钾,可以得到0.6g氧气。
例2、工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨?
解:
设:需要碳酸钙的质量为x。
CaCO3
CaO+CO2↑
100 56
x 10t
答:需要碳酸钙18t。
例3、用KClO3和MnO2共3g完全反应,质量减小了0.96g,生成氧气多少克?MnO2为多少克?
解:
(1)生成氧气的质量为0.96g,
(2)设KClO3的质量为x,
2KClO3
2KCl + 3O2↑
245 96
x 0.96g
245/96 =x/ 0.96g
x=2.45g
所以MnO2的质量为3g-2.45g=0.55g
答:生成氧气的0.96g ,MnO2为0.55g。
例4、20g H2和O2完全反应,生成了18g水,问H2和O2各为多少克?
解:
设反应的H2的质量为x,反应的O2的质量为y,
2H2 + O2
2H2O
4 32 36
x y 18g
4/36=x/18g
x=2g
32/36=y/18g
y=16g
①若H2有剩余,H2的质量为4g,反应的O2的质量为16g,
②若O2有剩余,H2的质量为2g,反应的O2的质量为18g。
总结:根据化学方程式计算的一般步骤:“设一写一找一列一解答”
(1)设:设未知量x。
(2)写:正确书写并配平化学方程式.
(3)找:找出相关物质的比例关系,并求出它们的相对分子质量,把已知量和未知量写在对应物质相对分子质量的下边。
(4)列:列出比例式。
(5)解答:解出未知量的值,写出答案。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -