例1、 (大连市)高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%。
(1)若10g碳酸钙全部分解可产生多少克氧化钙?
(2)实际反应生成的二氧化碳是多少克?
解析:
该题属于化学方程式和化学式的综合计算题。加热一段时间后停止加热,碳酸钙不一定全部分解,但化学反应前后钙元素的质量是守恒的。
答案:(1) 解:设10g碳酸钙全部分解可产生氧化钙的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
10g x
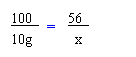
x=5.6 g
(2)10g碳酸钙钙元素质量:10g×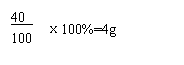
由于化学反应前后钙元素的质量守恒,因此反应后的剩余固体质量为: 4g÷50%=8g
根据质量守恒定律可知,实际反应生成的二氧化碳的质量为:10g-8g=2g
答:10g碳酸钙全部分解可产生5.6克氧化钙;实际反应生成的二氧化碳是2克.
例2、(重庆市)某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%。杨琳同学为了检验该产品,取10g补钙品放入100g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余固体和液体的总质量比反应前减少了2.2g。求:
⑴补钙品中实际含钙的质量分数是多少?
⑵所用稀盐酸中溶质的质量分数是多少?
解:设补钙品中碳酸钙的质量为x,稀盐酸中HCl的质量分数为y。
2HCl + CaCO3=CaCl2 +H2O +CO2↑
73 100 44
100g·y x 2.2g
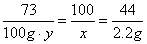
x=5g
y=3.65%
补钙品中实际含钙的质量分数是: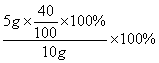 =20%
=20%
答:补钙品中实际含钙的质量分数是20%;所用稀盐酸中溶质的质量分数是3.65% 。