| 二氧化碳制取的研究(1) |
主编:黄冈中学化学集体备课组
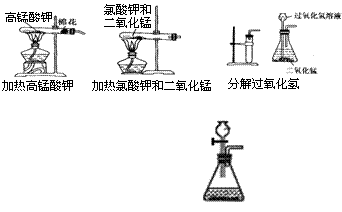
通过前面学习的O2和H2的实验定制法引入课题。
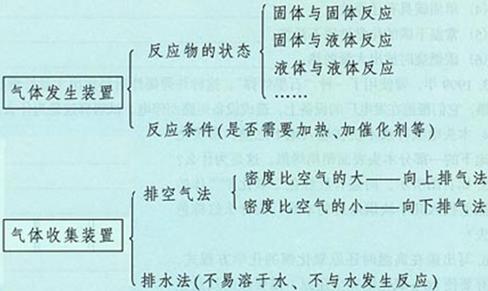
实验室制取气体的一般思路:
1、选择合适的反应(包括反应物和反应条件)
可以得到CO2的反应:
(1)C+O2
CO2
(2)石蜡+氧气
二氧化碳+水
(3)C+2CuO
2Cu+CO2↑
(4)3C+2Fe2O3
4Fe+3CO2↑
(5)2C+Fe3O4
3Fe+2CO2↑
(6)CaCO3
CaO+CO2↑
(7)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(8)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
(9)CaCO3+2HCl=CaCl2+H2O+CO2↑
(10)CaCO3+H2SO4=CaSO4+H2O+CO2↑
分析:各反应的特点
总结:选择依据:原料易得、操作方便、安全可行、经济环保。
演示:1、Na2CO3+HCl
2、Na2CO3+H2SO4
3、CaCO3+HCl
4、CaCO3+H2SO4
实验室制取CO2的原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
[CaCO3+2HCl=CaCl2+H2CO3,H2CO3=H2O+CO2↑]
2、选择合适的装置
(1)发生装置:(选择依据:根据反应物的状态和反应条件)
回顾:
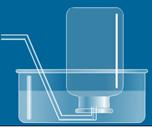
用Zn+H2SO4(稀)制氢气
反应物的状态(考虑试管口的方向)
反应条件(考虑是否需要加热)
(2)收集装置(选择依据:根据气体的密度与空气密度的大小,以及气体在水中的溶解性)
密度比空气大——向上排空气法(如O2、CO2)
密度比空气小——向下排空气法(如H2)
不易溶于水且不与水反应——排水法(如O2、H2)
讲解:三种气体制法及相关性质比较
|
反应物状态 |
反应条件 |
气体密度与空气密度大小 |
溶解性 |
CO2 |
固+液 |
常温 |
比空气大 |
能溶于水 |
O2 |
固+固或固+液 |
△或常温 |
比空气大 |
不易溶于水 |
H2 |
固+液 |
常温 |
比空气小 |
难溶于水 |
3、验证所制得的气体
O2:带火星的木条,看能否使带火星的木条复燃。
H2:点燃,看能否燃烧产生淡蓝色火焰。
CO2:用澄清的石灰水检验,看能否使澄清的石灰水变浑浊。
总结:
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -