|
一、选择题
1、Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶7 B.1∶9
C.1∶5 D.2∶9
2、24 mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3
C.+2 D.0
3、在一定条件下,PbO2与Cr3+反应,产物是 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( ) 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
A.3.0 mol B.1.5 mol
C.1.0 mol D.0.5 mol
4、一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3→HNO3+N2↑+H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5∶3 B.5∶4
C.1∶1 D.3∶5
5、硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-离子,则 将转化成( ) 将转化成( )
A.S2- B.S
C. D. D.
6、苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性 B.还原性
C.碱性 D.酸性
7、将 +Zn+OH-+H2O→NH3+ +Zn+OH-+H2O→NH3+ 配平后,离子方程式中H2O的系数是( ) 配平后,离子方程式中H2O的系数是( )
A.2 B.4
C.6 D.8
8、(NH4)2SO4在强热条件下分解生成NH3、SO2、N2和H2O。反应中生成的氧化产物和还原产物物质的量之比为( )
A.1∶3 B.2∶3
C.1∶1 D.4∶3
9、从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S是还原产物
B.5 mol FeS2是发生反应,有10mol电子转移
C.产物中的 离子有一部分是氧化产物 离子有一部分是氧化产物
D.FeS2只作还原剂
10、在一定条件下, 和氟气可发生如下反应: 和氟气可发生如下反应: +F2+2OH-= +F2+2OH-=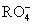 +2F-+H2O。从而可知在 +2F-+H2O。从而可知在 中,元素R的化合价是( ) 中,元素R的化合价是( )
A.+4 B.+5
C.+6 D.+7
二、填空题
11、完成并配平下列氧化还原反应方程。
(1)______Fe+______HNO3(稀)—______Fe(NO3)3+______NO↑+______H2O
(2) ______FeS+______H2SO4(浓)—______Fe2(SO4)3+______SO2↑+______S↓+______H2O
(3) ______P+______CuSO4+______H2O—______H2SO4+______Cu↓+______H3PO4
(4) ______Cl2+______Na2CO3—______NaCl+______NaClO3+______CO2↑
显示答案
|
答案:
(1)1;4;1;1;2
(2)2;6;1;3;2;6
(3)2;5;8;5;5;2
(4)3;3;1;5;3
|
12、配平下列反应方程式并标明电子转移的方向和总数。
(1) ______MnO2+______HCl(浓)= ______MnCl2+______Cl2↑+______H2O
(2) ______Na2O2+______CO2=______Na2CO3+______O2
显示答案
|
答案:
 |
13、在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中氧化剂是__________,还原剂是__________;当有0.64 g Cu溶解时有__________molHNO3被还原,在标准状况下放出__________L NO;电子转移总数是__________mol,总共消耗HNO3__________mol。
显示答案
|
答案:
HNO3; Cu;0.0067; 0.15;0.02; 0.01× |
14、验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素显__________。
(2)以上反应中的氧化剂为__________。当有1 molCuI参与反应时,转移电子__________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
______Cu2++______I-—______CuI+______
显示答案
|
答案:
(1)+1
(2)CuI;0.5
(3)2;5;2;1
|
15、在热的稀硫酸溶液中溶解了11.4g FeSO4。当加入50 mL 0.5 mol·L-1KNO3溶液后,使其中的Fe2+全部转移成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
______FeSO4+______KNO3+______H2SO4→
______K2SO4+______Fe2(SO4)3+______NxOy+______H2O
(1)推算出x=__________,y=__________。
(2)配平该化学方程式。
(3)反应中氧化剂为__________。
(4)用短线和箭头标出电子转移的方向和总数。
显示答案
|
答案:
(1)1;1
(2) 6FeSO4+2KNO3+4H2SO4=K2SO4+3Fe2(SO4)3+3NxOy+4H2O
(3)KNO3
(4)
|
|