|
一、选择题
1、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.AgNO3溶液
C.盐酸 D.氨水
2、NaH是离子化合物,与水反应生成碱和氢气,现有NaH和Al的混合物a g,与足量水充分反应后无固体剩余共收集到b g H2,则原混合物中铝粉的质量为( )
A.(12b-a)g B.(24a-5b)g
C.(36b-3a)g D.(a- )g )g
3、下列离子方程式不正确的是( )
A.Al3++4OH-= +2H2O +2H2O
B.Al3++3NH3·H2O=Al(OH)3↓+
C.Al(OH)3+NH3·H2O= + + +2H2O +2H2O
D.Al+2OH-= +H2↑ +H2↑
4、甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3 B.NaOH
C.BaCl2 D.FeSO4
5、两份等体积、等浓度的NaOH溶液,分别与体积相等的MgCl2、AlCl3溶液混合,充分反应后,Mg2+、Al3+均恰好形成沉淀,则原MgCl2、AlCl3溶液中Cl-浓度之比为( )
A.1∶1 B.1∶2
C.2∶3 D.3∶2
6、只用一种试剂就可以鉴别KCl、MgCl2、AlCl3、FeCl3,这种试剂是( )
A.AgNO3 B.NH3·H2O
C.NaOH D.BaCl2
7、将镁、铝和铁的粉末,分别投入相同体积、相同物质的量浓度的过量盐酸中,充分反应后,各溶液的质量相等,则下列叙述正确的是( )
A.放出氢气的质量是Al>Mg>Fe
B.投入的金属的质量是Al>Mg>Fe
C.放出氢气的质量是Fe>Mg>Al
D.投入的金属的质量是Fe>Mg>Al
8、某无色透明的溶液可以与铝作用产生氢气,其中可以大量共存的离子是( )
A.OH-、 、Ba2+、Cl- 、Ba2+、Cl-
B.H+、Mg2+、Ba2+、
C.H+、 、Al3+、Cu2+ 、Al3+、Cu2+
D.Na+、K+、 、Cl- 、Cl-
9、实验室毕要在坩埚内加热熔化氢氧化钠,下列坩埚中不可采用的是 )
A.氧化铝坩埚 B.氧化镁坩埚
C.粘土坩埚 D.铁坩埚
10、将一小块镁铝合金溶于盐酸后,加入过量的NaOH溶液,此时溶液中存在的是( )
A.Na+、Cl-、OH-、
B.Mg2+、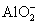 、Cl-、Na+ 、Cl-、Na+
C.Al3+、Mg2+、Cl-、Na+
D.Al3+、Mg2+、Cl-、Na+、
二、填空题
11、某无色溶液里,只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、 、OH-、 、OH-、 。已知:该溶液能跟金属铝反应,且放出的气体只有氢气,试回答: 。已知:该溶液能跟金属铝反应,且放出的气体只有氢气,试回答:
(1)若溶液跟铝反应只有 生成,则原溶液一定含有的大量物质是___________(写化学式),发生反应的方程式是___________,还可能含有的大量物质是___________。 生成,则原溶液一定含有的大量物质是___________(写化学式),发生反应的方程式是___________,还可能含有的大量物质是___________。
(2)若溶液跟铝反应后有Al3+生成,则原溶液中一定不含有的大量离子是___________。
显示答案
|
答案:
(1)NaOH 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ NaCl、NaNO3
(2) 、OH-、Ag+、 、OH-、Ag+、
|
12、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成 。 。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为___________ (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:______________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别是___________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式______________________。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因______________________。
显示答案
|
答案:
(1)
(2)Zn+2NaOH=Na2ZnO2+H2↑
(3)①③④
(4)Al3++3NH3·H2O=Al(OH)3↓+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成 ,氨水的用量不易控制 ,氨水的用量不易控制
(提示:(1)Al和NaOH发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。溶液中Al以 的形式存在。 的形式存在。
(2)仿照Al和NaOH的反应,可以写出方程式:
Zn+2NaOH=Na2ZnO2+H2↑
(3)①Al2(SO4)3滴入NaOH中没有沉淀,生成 ;NaOH滴入Al2(SO4)3中有沉淀;②Al2(SO4)3滴入氨水中有沉淀;氨水滴入Al2(SO4)3中也有沉淀;③ZnSO4滴入NaOH中没有沉淀,生成 ;NaOH滴入Al2(SO4)3中有沉淀;②Al2(SO4)3滴入氨水中有沉淀;氨水滴入Al2(SO4)3中也有沉淀;③ZnSO4滴入NaOH中没有沉淀,生成 ;NaOH滴入ZnSO4中有沉淀;④ZnSO4滴入氨水中没有沉淀,生成 ;NaOH滴入ZnSO4中有沉淀;④ZnSO4滴入氨水中没有沉淀,生成 ;氨水滴入ZnSO4中有沉淀。所以,用相互滴加的实验方法就能鉴别的有①③④。 ;氨水滴入ZnSO4中有沉淀。所以,用相互滴加的实验方法就能鉴别的有①③④。
(4)根据给出信息,写出方程式:Al3++3NH3·H2O=Al(OH)3↓+ 。可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成 。可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成 。所以实验过程中加入氨水的用量不易控制。 。所以实验过程中加入氨水的用量不易控制。
|
13、将一块表面附有10.2 g Al2O3的铝片A放入盛有1 L 1.5 mol·L-1热NaOH溶液的甲烧杯中,反应一段时间后,取出铝片,溶液质量增加了12.6 g。再将另一块表面附有AlO3的铝片B放入盛有1 L 0.9 mol·L-1稀H2SO4的乙烧杯中,反应一段时间后,铝片B质量减轻了25.8 g,溶液质量增重25.2 g,若反应前后甲、乙两烧杯中溶液体积不变仍为1L。试回答下列问题:
(1)甲烧杯中发生反应的化学方程式为______________________。甲烧杯、中溶液中的溶质是___________,其物质的量是___________。
(2)乙烧杯中发生化学反应的方程式为______________________。乙烧杯中溶质是___________,其物质的量是___________。
(3)若将甲、乙两烧杯中溶液混合,充分反应,可生成沉淀的物质的量为___________。
显示答案
|
答案:
(1)Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
NaOH,NaAlO2;1.2 mol,0.3 mol
(2)2Al+3H2SO4=Al2(SO4)3+3H2↑
Al2O3+3H2SO4=Al2(SO4)3+3H2O
Al2(SO4)3 0.3mol
(3)0.8mol
|
14、超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的食量,进行了以下两个实验: 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的食量,进行了以下两个实验:
(1)称取10.00 g样品,将其加入到过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为______________________;
②该样品中的AlN的质量分数为___________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。该样品中含杂质炭___________g。
显示答案
|
答案:
(1)①AlN+NaOH+H2O=NaAlO2+NH3↑
②AlN+NaOH+H2O=NaAlO2+NH3
41 g 22.4 L
m(AlN) 3.36 L
41g∶m(AlN)=22.4L∶3.36L m(AlN)=6.15 g
w(AlN)%= ×100%=61.5% ×100%=61.5%
(2)设C和O2反应生成CO消耗O2 xmol,
n(O2)= =0.09mol =0.09mol
由2C + O2 = 2CO △V
xmol 56x gx
C + O2 = CO2
(0.09-x)mol 44(0.09-x)g
知上述反应,每消耗1体积O2则生成2体积CO,而C+O2=CO2是一反应前后气体体积不变的反应。故依题意有
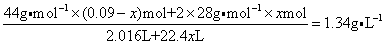
解之x=0.07 mol
杂质中含m(C)=44g·mol-1×(0.09-0.07)mol+28 g·mol-1×2×0.07mol-0.09 mol×32 g·mol-1=1.92 g。
|
|