| 引言、原子的诞生和能层与能级 |
主编:黄冈中学化学集体备课组
对于引言要了解以下几个问题:
1、化学研究的对象是什么?
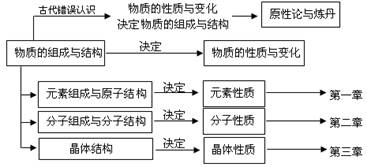
化学研究的对象是构成宏观物体的物质。对物质的研究可以分为物质的组成与结构和物质的性质与变化两个方面。
2、“物质的组成与结构”与“物质的性质与变化”两方面是什么关系?
物质的组成与结构决定物质的性质与变化。
古代错误认识:物质的性质与变化决定物质的组成与结构。如“原性论”“炼丹”。
3、物质的组成与结构如何决定物质的性质?
(1)元素的组成与原子结构决定元素的性质。如卤素与碱金属。
(2)分子的组成与分子结构决定分子的性质。
①分子的组成不同物质的性质不同。如O2和O3,CO和CO2。
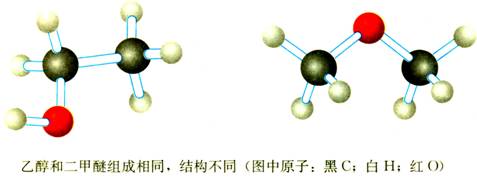
②有的分子组成相同但结构不同(同分异构体),物质性质不同。如乙醇和甲醚。
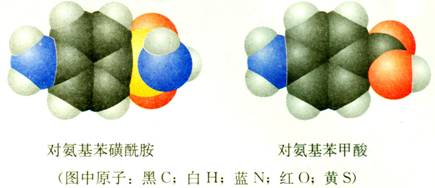
③有的分子组成不同,由于有类似的结构而有某些相近的性质。如对氨基苯磺酰胺和对氨基苯甲酸,模拟生物体中酶的结构,设计、创造与酶结构相似从而具有酶的性质的物质。
(3)晶体结构决定晶体的性质。如金刚石与石墨,方解石与霰石。
小结:
原子结构与性质
识图:第一章章图,人类对原子的认识史——不同时期的原子结构模型。
1、古希腊原子学说:公元前400多年前,希腊哲学家德谟克利特等人的观点认为,物质由原子构成,且原子是不可分的微粒;原子的结合和分离是万物变化的根本。
2、道尔顿原子模型:1803年,英国科学家道尔顿提出近代原子说认为,物质由原子组成,且原子为实心球体,不能用物理方法分割;同种原子的质量和性质相同。
3、汤姆生原子模型:1897年,英国科学家汤姆生发现了电子,1904年汤姆生提出原子结构的“葡萄干布丁”模型:原子是一个平均分布着正电荷的粒子,电子镶嵌其中并中和正电荷,使原子呈电中性,原子是可以再分的。
4、卢瑟福原子模型:1911年,卢瑟福提出原子由原子核和核外电子组成。原子核带正电荷,位于原子的中心并几乎集中了原子的全部质量,电子带负电荷,在原子核周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
5、波尔原子模型:19113年,波尔提出,电子在原子核外一定轨道上绕核作高速运动。
6、原子结构的量子力学模型(电子云模型):1927-1935年,现代原子结构学说诞生,现代科学家用量子力学的方法描述核外电子运动,即运用电子云模型描述核外电子的运动。
原子结构
一、开天辟地—原子的诞生
复习:必修中学习的原子核外电子排布规律:
(1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原于最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)。
(4)次外层电子数目不能超过18个,倒数第三层电子数目不能超过32个。
二、能层与能级
1、能层(电子层)
能 层 一 二 三 四 五 六 七 ……
符 号 K L M N O P Q ……
能量大小 K<L<M<N<O<P<Q
离核距离
2、能级(亚层)
能 层 K L M N ……
能 级 1s 2s2p 3s 3p 3d 4s 4p 4d 4f ……
能级最多电子数 2 2 6 2 6 10 2 6 10 14 ……
能层最多电子数 2 8 18 32 ……
各能层最多容纳的电子数是2n2个(n:能层的序数)
注意:
(1)每个能层中,能级符号的顺序是ns、np、nd、nf……
能量:ns<np<nd<nf。
(2)任一能层的能级总是从 S能级开始,且能级数=能层序数。如:第一能层只有1个能级:1s,第二能层有2个能级:2s、2p,第三能层有3个能级:3s 、3p、3d,依次类推。
(3)s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍,即
s能级:最多容纳2个电子;p能级:最多容纳6个电子;
d能级:最多容纳10个电子;f能级:最多容纳14个电子。
(4)英文字母相同的不同能级中所能容纳的最多电子数相同。
思考:第五能层中所能容纳的最多电子数是多少?说出你推导的两种方法。
第一、依据每一个能层最多可容纳的电子数为2n2个,当n=5,2n2=50。
第二、第五能层中有5个能级—5s、5p、5d、5f、5g,最多电子数分别是2、6、10、14、18,所能容纳的最多电子数为50。
随堂练习:
1、下列能级中最多容纳的电子数为10的是( )
A.s能级 B.p能级
C.d能级 D.f能级
答案:C
2、下列各电子能层中,不包含d能级的是( )
A.N能层 B.M能层
C.L能层 D.K能层
答案:CD
3、以下能级符号正确的是( )
A.3s B.2d
C.4g D.4p
答案:AD
4、下列各组粒子中,各能层电子数均达到2n2个的是( )
A.Ne和Ar B.H-和Na+
C.Ne和Cl D.F-和S2-
答案:B
5、在第n电子层中,当它作为原子的最外层时容纳电子数最多与第(n-1)层相同;当它作为原子的次外层时,其电子数比(n-1)层多10个,则对此电子层的判断正确的是( )
A.必为K层 B.只能是L层
C.只能是M层 D.可以是任意层
答案:C
6、有A、B两种原子,A原子的M能层比B原子的M能层少3个电子,B原子的L能层电子数恰好为A原子L能层电子数的2倍。A和B分别是( )
A.Si和Na B.B和He
C.Cl和O D.C和Al
答案:D
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班