| 配合物理论简介 |
主编:黄冈中学化学集体备课组
实验:展示①CuSO4、②CuCl2·2H2O、③NaCl、④K2SO4固体的颜色,将它们溶于水,观察水溶液的颜色。
现象:CuSO4、CuCl2的溶液呈天蓝色,NaCl、K2SO4的溶液为无色。
思考:1)固态时,Cu2+、SO42-、Cl-呈什么颜色?
2)水溶液中,Cu2+、SO42-、Cl-呈什么颜色?
3)为什么Cu2+在固态时和水溶液中的颜色不同?
1、配位键:
(1)概念:共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。
(2)表示: A → B
电子对给予体 电子对接受体
(3)条件:其中一个原子必须提供孤对电子,另一原子必须有能接受孤对的原子轨道。
举例:H3O+
(
)
NH4+
(
)
2、配位化合物
(1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。
作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。
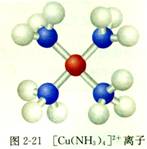
[Cu(H2O)4]2+的空间结构为平面正方形。
(2)配合物的结构
[Cu(NH3)4]SO4为例说明。
注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。
(3)配合物的命名
例如:[Cu(NH3)4]SO4 硫酸四氨合铜
练习:对下列配合物进行命名
[Cu(NH3)4]Cl2 K3[Fe(SCN)6] Na3[AlF6]
3、几种常见的配合物
实验:硫酸四氨合铜的制备。
现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。再加入乙醇,析出深蓝色的晶体。
有关反应的离子方程式为:
Cu2++2NH3·H2O=Cu(OH)2↓+2OH-
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
蓝色沉淀 深蓝色溶液
在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+:
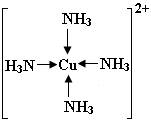
[Cu(NH3)4]2+的空间结构为平面正方形。
实验:硫氰化铁的制备。向氯化铁溶液中滴加硫氰化钾溶液。
现象:形成血红色溶液。
有关反应的化学方程式为:
FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。上述实验可用于鉴定溶液中存在Fe3+。
呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。
注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
随堂练习:
1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有( )
A.离子键和共价键 B.离子键和配位键
C.配位键和共价键 D.离子键
答案:C
2.下列属于配合物的是( )
A.NH4Cl B.Na2CO3·10H2O
C.CuSO4·5H2O D.Co(NH3)6Cl3
答案:CD
3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③
C.①②④ D.①②③④⑤
答案:D
4.配合物在许多方面有着广泛的应用。下列叙述不正确的是( )
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
答案:D
5.下列微粒:①H3O+ ②NH4+ ③CH3COO- ④NH3 ⑤CH4中含有配位键的是( )
A.①② B.①③
C.④⑤ D.②④
答案:A
6.下列不属于配位化合物的是( )
A.六氟和铝酸钠 B.氢氧化二氨合银(银氨溶液)
C.六氰合铁酸钾 D.十二水硫酸铝钾
答案:D
7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。
8.亚硝酸根NO2-作为配体,有两种方式。其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。前者称为硝基,后者称为亚硝酸根。
[Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -