1.关于配位键的形成,下列说法正确的是( )
A.提供电子对的原子一般要有孤对电子
B.接受电子对的原子一般要有空轨道
C.任意两个原子间都可以形成配位键
D.配位键一般是单键,和普通单键性质不同
2.下列物质中不存在配位键的是( )
A.NH4+ B.[Cu(NH3)4]2+
C.NH3 D.H3O+
3.CuCl2溶液有时呈黄色,有时呈黄绿色,有时却是蓝色,这是因为CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl-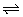 [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色 黄色
要使一份黄色的CuCl2溶液变成黄绿色或蓝色,可以往溶液中加入( )
A.NaCl溶液 B.水
C.AgNO3溶液 D.Na2S溶液
4.已知Co3+的配位数为6,将化学组成为CoCl3·4NH3的紫色固体配制成溶液,向其中加入足量的AgNO3溶液后,只有1/3的氯从沉淀析出。该配合物的内界含有( )
A.1个NH3 B.2个Cl-和2个NH3
C.2个Cl-和3个NH3 D.2个Cl-和4个NH3
5.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O;②NH3;③F-;④CN-;⑤CO
A.①② B.①②③
C.①②④ D.①②③④⑤
6.气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如图所示: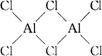 。若将图中是配位键的斜线上加上箭头,下列4个选项中正确的是( )
。若将图中是配位键的斜线上加上箭头,下列4个选项中正确的是( )

7.配合物在许多方面有着广泛的应用。下列叙述不正确的是( )
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
8.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道
9.NH3和BF3可以通过配位键形成化合物NH3·BF3。下列说法正确的是( )
A.NH3、BF3两分子的中心原子采取的都是sp2杂化
B.NH3、BF3两分子的中心原子采取的都是sp3杂化
C.形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道
D.形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道
10.已知[Co(NH3)6]3+呈正八面体结构,各NH3分子间距相等,Co3+位于正八面体的中心。若其中二个NH3分子被Cl-取代,所形成的[Co(NH3)4Cl3]+的同分异构体的种数有( )
A.2种 B.3种
C.4种 D.5种
11.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式:FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)该反应的类型是__________,生成物中KCl既不是难溶、难电离物质,也不是易挥发物质,则该反应之所以能够进行是由于生成了__________的Fe(SCN)3。
(2)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显血红色。该离子的离子符号是__________,含该离子的配合物的化学式是______________。
②若Fe3+与SCN-以个数比1∶5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______________________________。
(3)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于__________(填字母代号)。
A.与Fe3+配合的SCN-数目增多
B.血红色离子的数目增多
C.血红色离子的浓度增加
12.Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。
(1)若在第一种配合物的溶液中加BaCl2溶液时,产生________________;
(2)如果在第二种配合物的溶液中加入BaCl2溶液时,________________现象。
(3)若在第二种配合物的溶液中加入AgNO3溶液时,________________。
13.把(NH4)2CO3浓溶液逐滴滴入AgNO3稀溶液中,开始时出现浑浊,其后逐渐成为无色透明溶液。试回答:
(1)试述出现上述现象的主要原因。
______________________________________________________________________
(2)若向得到的透明溶液中加入过量的稀盐酸,试述发生的现象,并写出有关的离子反应方程式。
______________________________________________________________________
15.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为______________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
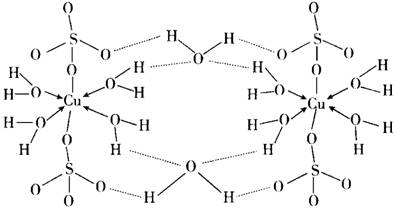
下列说法正确的是__________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.胆矾中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________________。