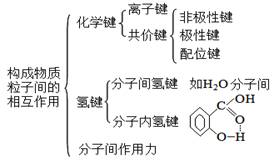
| 范德华力、氢键及其对物质性质的影响 |
主编:黄冈中学化学集体备课组
一、范德华力及其对物质性质的影响
1、范德华力:把分子聚集在一起的作用力叫做分子间作用力,又称范德华力。
表1:某些分子的范德华力
分子
Ar
CO
HI
HBr
HCl
范德华力/(kJ·mol-1)
8.50
8.75
26.00
23.11
21.14
思考:
(1)范德华力与化学键键能大小比较,哪个大?
范德华力很弱,约比化学键的键能小1~2数量级。
(2)为什么Ar的范德华力比CO的小?CO的范德华力比HCl、HBr、HI的小?
Ar为非极性分子,而CO为极性分子,因而Ar的范德华力比CO的小;虽然CO、HCl、HBr、HI均为极性分子,但分子的极性HCl、HBr、HI都比CO的大,因而HI、HBr、HCl的范德华力都比CO的大。
(3)为什么HCl、HBr、HI的范德华力逐渐增大?
HCl、HBr、HI的结构相似,且HI、HBr、HCl的相对分子质量逐渐减小,因而HCl、HBr、HI的范德华力逐渐增大。
结论:分子的极性越大,范德华力越大;结构相似时,相对分子质量越大,范德华力越大。
小结:
(1)本质:分子间的微弱的电性引力。
(2)分子间作用力比化学键弱得多。如:HCl分子中H-Cl键能为431.8kJ/mol,而HCl分子间作用力为21.1kJ/mol。
(3)只有分子充分接近时才有分子间作用力,如固体和液体中。
(4)分子的极性越大,范德华力越大;结构相似时,相对分子质量越大,范德华力越大。
(5)化学键是决定物质化学性质的主要因素,而范德华力则是决定由分子构成的物质的物理性质的主要因素。
注意:离子化合物的物理性质由离子键决定,某些共价键形成的物质(原子晶体如SiO2、SiC、金刚石等)的物理性质由共价键决定,金属的物理性质由金属键决定。
表2:卤素单质的熔点和沸点
单质
熔点/℃
沸点/℃
F2
-219.6
-118.1
Cl2
-101.0
-34.6
Br2
-7.2
58.5
I2
113.5
184.4
思考:怎样解释卤素单质从F2~I2的熔、沸点越来越高?
分子结构相似时,相对分子质量越大,范德华力越大,物质的熔沸点越高。因此,由于F2~I2的相对分子质量逐渐增大,范德华力也逐渐增大,使F2~I2的熔、沸点越来越高。
2、范德华力对物质性质的影响
由分子构成的物质,分子结构相似时,相对分子质量越大,范德华力越大,物质的熔沸点越高。如:
熔沸点:I2>Br2>Cl2>F2;Ar>Ne>He;ClI4>CBr4>CCl4>CF4
沸点:SnH4>GeH4>SiH4>CH4
原因:分子间作用力作用力越大,克服分子间引力使物质熔化或汽化就需要更多的能量,物质的熔沸点就越高。
二、氢键及其对物质性质的影响
1、氢键的概念:氢键是由已经与电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
2、氢键的本质:氢键是除范德华力之外的另一种分子间作用力。是分子之间的一种静电引力。
3、氢键的表示:A-H…B-
A、B均为电负性很大的原子,如:N、F、O。
“-”表示共价键;“…”表示氢键。
4、氢键的形成条件:
(1)对于A-H…B-来说,A、B都必须是电负性很大(吸引电子能力强)的原子,B的原子半径要小(越易接近A-H)且有孤对电子(带负电荷且负电荷高),如F、O、N等。
(2)A-H键的极性要强,使共用电子对强烈地偏向X原子一方,使H原子几乎成为“裸露”的质子(带正电荷高)。
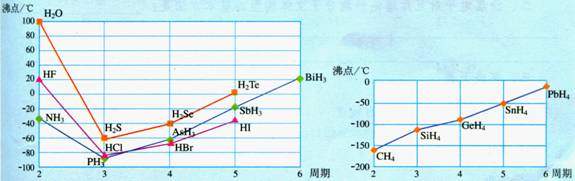
注意:①F-H…F是最强的氢键。Cl原子的吸引电子的能力强,但原子半径大,Cl-H…Cl的氢键很弱;C原子虽然原子半径很小,但吸引电子的能力弱,几乎不能形成氢键。因此,HF、H2O、NH3有反常的沸点,而HCl、CH4的沸点符合范德华力的规则。
②不仅相同物质之间能形成氢键,不同物质之间也能形成氢键。如:水分子之间,氟化氢分子之间,氨分子之间存在氢键,水分子与氟化氢以及水分子与氨分子之间也存在氢键。再如乙醇能与水以任意比例互溶,是由于乙醇分子与水分子之间能形成氢键。
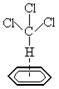
③特殊的氢键,如CHCl3比CH3CCl3易溶解于苯中,是由于CHCl3中的H与苯环中电子形成了氢键。
5、氢键的特征
(1)有饱和性:在A-H…B中,H原子只能与一个B原子结合。原因是在A-H…B中,H原子半径太小,如果再吸引另一个B原子,此B原子必须受到A、B原子的排斥,这个排斥力大于氢原子对它的吸引力,实际上不可能在形成氢键。
(2)有方向性:A-H…B 中3个原子在同一直线上氢键最强。如:
6、氢键对物质性质的影响:
(1)氢键的存在大大加强了分子之间的作用力,使物质的熔、沸点较高。如:水、氟化氢、氨的熔沸点较高。
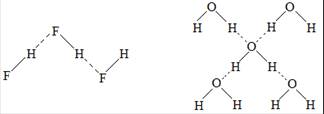
(2)形成“缔合分子”。如接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互“缔合”形成的“缔合水分子”[(H2O)n],使接近水的沸点的水蒸气的相对分子质量测定值比用化学式H2O计算出来的相对分子质量大一些。
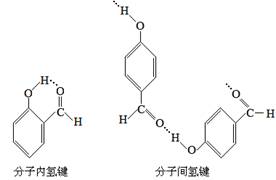
7、氢键的分类:分子内氢键,分子间氢键。
注意:邻羟基苯甲酸只能在分子内形成氢键,对羟基苯甲酸只能在分子间形成氢键,因而,前者的沸点低于后者的沸点。
8、氢键的键能、键长
表3:某些氢键的键能和键长
氢键A-H…B
键能/(kJ·mol-1)
键长/pm
代表性分子
F-H…F
28.1
255
(HF)n
O-H…O
18.8
276
冰
O-H…O
25.9
266
甲醇、乙醇
N-H…F
20.9
268
NH4F
N-H…O
20.9
286
CH3CONH2
N-H…N
5.4
338
NH3
(1)氢键的键能:介于范德华力与化学键之间。约为化学键的十分之几,不属于化学键,是一种分子间作用力。
(2)氢键的键长:A-H…B的长度。
9、氢键的应用
(1)HF、H2O、NH3的熔沸点反常的高。
(2)NH3易压缩、易液化,易溶于水。
(3)缔合分子的形成,如:(H2O)n、(HF)n等。
(4)水结冰是体积膨胀,密度减小。
(5)比较某些有机物的溶解性和熔沸点高低。如乙醇、乙酸都能与水以任意比例互溶,乙醇的熔沸点比溴乙烷(CH3CH2Br)高等。
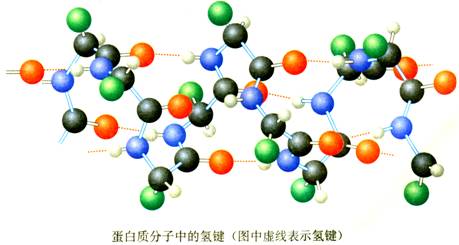
(6)DNA的结构和生理活性与氢键的作用有关等。
10、化学键、分子间作用力与氢键的关系和比较
(1)相互关系
(2)离子键、共价键、氢键和范德华力的比较
离子键
共价键
氢键
范德华力
本质
阴、阳离子之间的静电作用
共用电子对对成键原子的电性引力
氢原子与吸引电子能力强、半径小的原子所产生的静电吸引作用
分子间微弱的电性引力(静电作用)
特点
无方向性、无饱和性
有方向性、有饱和性
有方向性、有饱和性
无方向性、无饱和性
强度
强烈
强烈
比化学键弱得多、比分子间作用力强
比化学键弱得多、比氢键稍弱
范围
相邻阴、阳离子之间
共价分子内或原子晶体相邻原子之间
分子间
分子间
影响性质
影响物质的物理性质和化学性质
影响物质的化学性质,对于原子晶体还影响物质的物理性质
影响物质的物理性质
影响物质的物理性质
(板书有误:范德华力比化学键弱得多,比氢键稍弱。误写成了比氢键稍强。)
典型例题
1、下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A.CO2和SiO2 B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2 D.NaH和KCl
答案:D
2、下列说法正确的是( )
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D.冰熔化时只破坏分子间作用力
答案:B
3、沸腾时只需克服范德华力的液体物质是( )
A.水 B.酒精
C.溴 D.水银
答案:C
4、下列物质中分子间能形成氢键的是( )
A.N2 B.HBr
C.NH3 D.H2S
答案:C
5、以下说法正确的是( )
A.氢键是化学键
B.甲烷可与水形成氢键
C.乙醇分子跟水分子之间存在范德华力
D.碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键
答案:C
6、乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成均为C2H6O,但乙醇的沸点为78.5℃,而二甲醚的沸点为-23℃,为何原因?
答案:
乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成相同,两者的相对分子质量也相同,但乙醇分子之间能形成氢键,使分子间产生了较强的结合力,沸腾时需要提供更多的能量去破坏分子间氢键,而二甲醚分子间没有氢键,所以乙醇的沸点比二甲醚的高。
7、你认为水的哪些物理性质与氢键有关?
答案:
水的熔沸点较高,水结冰时体积膨胀,密度减小等。
8、如何用分子间力解释图中曲线的形状?
答案:
两张图表明气态氢化物的沸点一般是随相对分子质量增加而增大的,这是由于相对分子质量越大,范德华力越大,沸点越高。但HF、H2O和NH3的沸点反常的高,表明在它们的分子间存在较强的相互作用,即氢键。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -