|
一、选择题
1.下列氢化物在液态时,分子间不存在氢键的是( )
A.HF B.H2O
C.NH3 D.CH4
2.下列说法不正确的是( )
A.分子间作用力是分子间相互作用力的总称
B.分子间作用力与氢键可同时存在于分子之间
C.氢键是一种特殊化学键,它广泛地存在于自然界中分子间
D.氢键的形成除使物质的熔、沸点升高,对物质的溶解度、硬度等也都有影响
3.下列气体最难液化的是( )
A.H2 B.O2
C.N2 D.Cl2
4.固体乙醇晶体中不存在的作用力是( )
A.离子键 B.共价键
C.氢键 D.分子间力
5.下列氢键中最强的是( )
A.S—H…O B.N—H…N
C.F—H…F D.C—H…N
6.在HCl、HBr、HI、HF中,沸点最低的是( )
A.HF B.HCl
C.HBr D.HI
7.关于氢键,下列说法正确的是( )
A.每一个水分子内含有两个氢键
B.在所有的水蒸气、水、冰中都含有氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
8.下列说法不正确的是( )
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D.冰融化时只破坏分子间作用力
9.SiH4的沸点比CH4高,其主要原因为( )
A.SiH4分子间的范德华力比CH4强
B.SiH4是极性分子,CH4是非极性分子
C.SiH4分子内的共价键比CH4强
D.SiH4分子间会产生氢键,CH4则不会
10.不存在氢键的是( )
A.纯H2O中的H2O分子之间
B.液态HF中的HF分子之间
C.NH3·H2O分子中的NH3与H2O之间
D.可燃冰CH4·nH2O中的CH4与H2O之间
二、填空题
11.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请同答下列问题:
(1)X、Y的元素符号依次为__________、__________。
(2)XZ2与YZ2分子的立体结构分别是__________和__________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是______________________________。
(3)Q的元素符号是__________,它属于第__________周期元素,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键____________________。
显示答案
|
11.解析:根据电子的核外排布规律,能量最低原理,X原子核外的M层中只有两对成对电子,故X为硫元素,Y原子核外的L层电子数是K层的两倍,共有6个电子,Y为碳元素,Z是地壳内含量(质量分数)最高的元素为氧元素,Q的核电荷数是X与Z的核电荷数之和,Q的核电荷数为24,是铬元素,在元素周期表的各元素中电负性最大的是氟元素。XZ2与YZ2分子为SO2、CO2,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大。H易与O、F、N形成氢键。
答案:(1)S;C
(2)V形;直线形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr;四;1s22s22p63s23p63d54s1;+6
(4)F—H…F,F—H…O,O—H…F,O—H…O |
12.现有A、B两有机物,结构简式分别为A: ,B: ,B: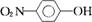 ,A可通过分子内氢键形成一个六元环,而B只能通过分子间氢键缔合。 ,A可通过分子内氢键形成一个六元环,而B只能通过分子间氢键缔合。
(1)若用“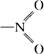 ”表示硝基、用“…”表示氢键,请画出A分子形成分子内氢键时的结构__________。 ”表示硝基、用“…”表示氢键,请画出A分子形成分子内氢键时的结构__________。
(2)A、B分别溶于水,__________(填A或B)的溶解度稍大些。
(3)工业上用水蒸气蒸馏法分离A、B的混合物,则首先被蒸出的成分是__________(填A或B)。
显示答案
|
12.(1)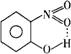 ; ;
(2)B ;
(3)A |
13.水分子间存在氢键的作用使水分子彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体——冰,其结构如图所示。
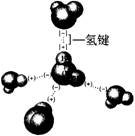
(1)1mol冰中有__________mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为______________。
(3)H2O的熔、沸点比H2S的熔、沸点__________(填“高”或“低”),为什么?____________________________________________________________。
显示答案
|
13.(1)2
(2)2H2O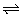 H3O++OH- H3O++OH-
(3)高; H2O分子间存在比范德华力更强的氢键,使其熔、沸点比H2S的高
解析:因为冰中每个水分子与周围4个水分子形成氢键,而每个氢键为两个水分子所共有,故每个水分子形成的氢键数为4×1/2=2,故1mol冰中有2mol氢键。 |
14.下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,请回答下列问题:
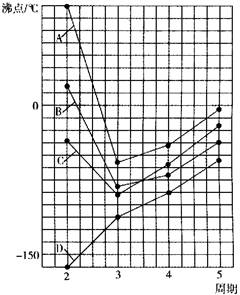
(1)其中表示ⅥA族元素气态氢化物沸点的是曲线__________;表示ⅣA族元素气态氢化物沸点的是曲线__________。
(2)同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是______________________________。
(3)A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是__________________________,如果把这些氢化物分子间存在的主要影响沸点的相互作用表示为A—H…A,则A元素一般具有的特点是__________________。
显示答案
|
14.(1)A; D
(2)气态氢化物由分子组成,相对分子质量越大范德华力越大,沸点越高
(3)H2O、HF、NH3分子存在氢键;电负性大 |
15.现有四种系列同族元素形成的物质,它们的沸点(0℃,p=1.01×105Pa)如下表所示:
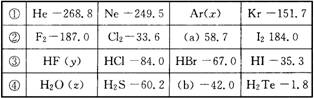
试根据上表回答下列问题
(1)a为__________色液体;b的分子式为__________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)__________;能够说明该递变规律的化学事实是__________(任举一例,用离子方程式表示)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是____________________。
(4)上表中,__________和__________两种物质的沸点较同系列其他物质反常,反常的主要原因是______________________________。
显示答案
|
15.(1)红棕;H2Se
(2)从左到右氧化性逐渐减弱; Cl2+2Br-=2Cl-+Br2
(3)随着相对分子质量增大,沸点逐渐升高
(4)HF;H2O;它们分子间易形成氢键 |
|