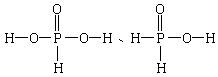| 溶解性、手性和无机含氧酸分子的酸性 |
主编:黄冈中学化学集体备课组
一、溶解性
思考:
(1)影响物质在水中的溶解度的外界因素有哪些?
答案:
影响物质在水中的溶解度的外界因素有温度和压强。对于固体物质,大多数温度越高,溶解度越大,压强对固体物质的溶解度影响很小。对于气态物质,温度越高,溶解度越小,压强越大,溶解度越大。
(2)为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?
答案:
物质的相互溶解还与分子结构有关,蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子,物质的相互溶解遵循“相似相溶”规律:非极性物质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。所以蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳。
(3)为什么乙醇(CH3CH2OH)与水能以任意比例互溶,甲醚(CH3OCH3)在水中能一定量的溶解(100ml水中可溶解3.7mL二甲醚气体),而氯乙烷(CH3CH2Cl)却难溶于水?
答案:
乙醇为极性分子,且乙醇与水分子之间存在较强氢键,所以乙醇与水能以任意比例互溶;甲醚虽然为极性分子,但分子的极性比乙醇小,且甲醚与水分子之间的氢键较弱(比乙醇的弱得多),所以甲醚在水中能一定量的溶解,但溶解度较小;氯乙烷也为极性分子,但分子的极性很小(比乙醇、甲醚小得多),更主要的是,氯乙烷与水分子之间无氢键,无氢键相互作用的溶质在有氢键的水中的溶解度比较小,所以氯乙烷难溶于水。
(4)为什么戊醇(CH3CH2CH2CH2CH2OH)在水中的溶解度比乙醇的小得多?
答案:
“相似相溶”规律还适用于分子结构的的相似性。乙醇分子中的-OH与水分子的-OH相近,因而乙醇能与水互溶;而戊醇分子中的烃基较大,其中的-OH跟水分子的-OH的相似因素小得多,因而它在水中的溶解度明显减小。
(5)为什么SO2在水中的溶解度(1∶40)较大?
答案:
SO2与水反应生成亚硫酸,亚硫酸可溶于水,增加了SO2的溶解度。
小结:
1、“相似相溶”规律:非极性物质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
2、若存在氢键,溶质和溶剂之间的氢键作用力越大,溶解性越好。无氢键相互作用的溶质在有氢键的水中的溶解度比较小。
3、“相似相溶”规律还适用于分子结构的的相似性。
4、若溶质遇水能反应将增加其在水中的溶解度。
思考:
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
答案:
NH3为极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规则,NH3易溶于水,而CH4不易溶于水。并且NH3与水之间还可形成氢键,使得NH3更易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?
答案:
油漆的主要成分是非极性分子,有机溶剂(如乙酸乙酯等)也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规则,应当用有机溶剂溶解油漆而不能用水溶解油漆。
(3)碘在纯水还是在四氯化碳中溶解性较好?为什么?
答案:
碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性溶剂。
二、手性
1、手性异构体和手性分子
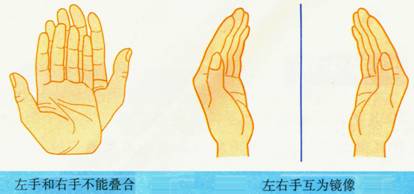
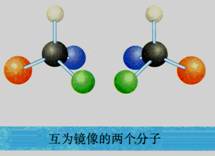
手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
手性分子:有手性异构体的分子叫做手性分子。
2、手性分子的判断
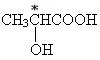
(1)在有机物中有碳原子上连有四个不同的原子或基团的分子为手性分子。
(2)手性碳原子:把连有四个不同的原子或基团的碳原子叫手性碳原子。
如:
3、手性分子的应用
(1)手性分子在生命科学和生产手性药物方面有广泛的应用。
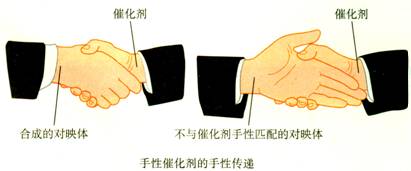
(2)运用手性催化剂进行手性合成。
三、无机含氧酸的酸性
思考:
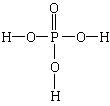
HNO3、H2SO4、H3PO4分别为一元酸、二元酸、三元酸,从分子结构上看,对于无机含氧酸中能电离的H在分子结构上有何特点?
答案:
HNO3、H2SO4、H3PO4的结构式分别为:
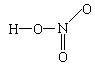
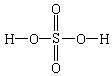
从分子结构上看,酸分子中能电离的氢都与酸根上的一个氧原子相连,并非与酸根中中心非金属元素相连。
1、无机含氧酸的结构特点:无机含氧酸分子中能电离的氢与酸根上的一个氧原子相连,即能电离的氢是含氧酸分子中的羟基(-OH)氢。
练习:已知H3PO3(亚磷酸)、H3PO2(次磷酸)的结构式分别为:
请判断H3PO3、H3PO2分别为几元酸?
答案:
H3PO3为二元酸,H3PO2为三元酸。
思考:
已知酸性:H2SO3<H2SO4,HNO2<HNO3,HClO<HClO2<HClO3<HClO4,说明同一种元素的含氧酸的酸性强弱与什么有关?
答案:
与元素的化合价有关,元素的化合价越高,其含氧酸的酸性越强。
2、无机含氧酸酸性强弱的判断:
(1)对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。如:
酸性:H2SO3<H2SO4 HNO2<HNO3 HClO<HClO2<HClO3<HClO4
解释:含氧酸的通式为(HO)mROn,如果成酸元素R相同,则n越大,R的正电性越高(R的化合价越高),导致R-O-H中的O的电子向R偏移,因而在水分子的作用下,也就容易电离出H+,即酸性越强。如:
硫酸:(HO)2SO2,n为2,亚硫酸:(HO)2SO,n为1,所以酸性:硫酸>亚硫酸。
硝酸:(HO)NO2,n为2,亚硝酸:(HO)NO,n为1,所以酸性:硝酸>亚硝酸。
HClO、HClO2、HClO3、HClO4中n分别为0、1、2、3,所以酸性:HClO<HClO2<HClO3<HClO4。
注意:酸性大小与—OH数目即m值大小无关,如H3PO4为中强酸,并非强酸,H2SO3与H2SO4中m均为2,但酸性H2SO3< H2SO4。
(2)对于不同元素的含氧酸来说,成酸元素的非金属性越强,该含氧酸的酸性越强。可根据元素周期律判断。如:
H2SiO4<H3PO4<HClO4。
解释:成酸元素的非金属性越强,吸引电子的能力越强,导致R-O-H中的O的电子向R偏移,因而在水分子的作用下,也就容易电离出H+,即酸性越强。
(3)经验规则:含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中n值越大,酸性越强。如:
硼酸(H3BO3):(HO)3B 次氯酸(HClO):HOCl 酸性相近
磷酸:(HO)3PO 亚硝酸:(HO)NO 酸性相近
硫酸:(HO)2SO2 硝酸:(HO)NO2 酸性相近
高溴酸:(HO)BrO3 高氯酸:(HO)ClO3 酸性相近
思考:
碳酸[(HO)2CO]中非羟基氧的个数为1,应是一个强度与亚硝酸和磷酸相近的中强酸,事实上二氧化碳水溶液的酸性很小,为什么?
答案:
原因是CO2的水溶液中溶于水的CO2分子只有约几百分之一与水结合成碳酸,实际H2CO3分子的浓度很小,导致二氧化碳水溶液的酸性很小。
典型例题:
1.把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是( )
A.四氯化碳 B.乙醇
C.二硫化碳 D.苯
答案:B
2.根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
A.乙烯 B.二氧化碳
C.二氧化硫 D.氢气
答案:C
3.下列氯元素含氧酸酸性最强的是( )
A.HClO B.HClO2
C.HClO3 D.HClO4
答案:D
4.下列物质中溶解度最小的是( )
A.LiF B.NaF
C.KF D.CsF
答案:A
5.下列说法不正确的是( )
A.互为手性异构的分子组成相同,官能团不同
B.手性异构体的性质不完全相同
C.手性异构体是同分异构体的一种
D.利用手性催化剂合成可得到或主要得到一种手性分子
答案:A
6.下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH(NH2)—COOH
C.CH3CH2OH D.CH3—OH
答案:B
7.无机含氧酸的强弱的规律表示成酸元素的化合价越高,酸性越强( )
A.根据这一规律高氯酸是很强的酸
B.H3PO4的酸性比盐酸强
C.碳酸和亚硫酸的酸性不好比较
D.硝酸与磷酸的酸性一样
答案:AC
8.根据手性碳相关知识回答:
(1)据报道近年合成的有机物A(
)具有光学活性,若要使A失去光学活性,可将A与浓硫酸共热,使
变为
。
列出可采用的其他方法(最少列举三种方法)
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
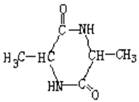
(2)某有机物B的化学式为C3H7NO2,B既能与强酸溶液反应,又能与强碱溶液反应。且B具有光学活性。则B的结构简式为____________________;
已知二分子B在一定条件下生成环状化合物C,则C的结构简式为______________;
若B能在一定条件下生成高分子化合物D,写出B形成D的化学方程式:______________________________。
答案:
(1)①将A与H2加成,使—CHO变为—CH2OH
②将A氧化,使—CH2OH变为—CHO
③将A与CH3COOH酯化,使—CH2OH变为
④将A水解,使
(2)
;
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -