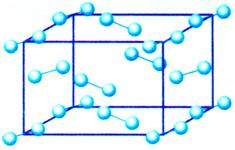
| 晶体的常识 |
主编:黄冈中学化学集体备课组
一、晶体与非晶体
思考:
固体有晶体和非晶体之分,有下列固体:白磷、硫磺、碘、高锰酸钾、蓝色的硫酸铜(CuSO4·5H2O)、玻璃,哪些属于晶体?哪些属于非晶体?
答案:
绝大多数常见的固体是晶体,上述物质中,白磷、硫磺、碘、高锰酸钾、蓝色的硫酸铜(CuSO4·5H2O)都属于晶体,只有玻璃之类的物质属于非晶体(又称玻璃体)。
思考:
在初中化学中,大家已学过晶体与非晶体,你知道它们之间有什么差异?
答案:
晶体有固定熔点,而非晶体无固定熔点。
1、晶体与非晶体的本质差异
晶体与非晶体的本质差异
|
自范性 |
微观结构 |
晶体 |
有 |
原子在三维空间里呈周期性有序排列 |
非晶体 |
没有 |
原子排列相对无序 |
自范性:晶体能自发性呈现多面体外形的性质。
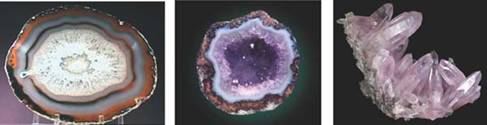
注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。
如:同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶。
天然水晶里的玛瑙和水晶
2、晶体形成的一般途径
(1)熔融态物质凝固;
(2)气态物质冷却不经液态直接凝固(凝华);
(3)溶质从溶液中析出。

提问:
晶体能自发性呈现多面体外形,那么固体粉末不是晶体这句话对吗?为什么?
答案:
许多固体的粉末用肉眼看不到晶体外形,但我们可以借助于显微镜观察,可观察到规则的晶体外形。这充分证明固体粉末仍是晶体,只不过晶粒太小,肉眼看不到而已。
提问:
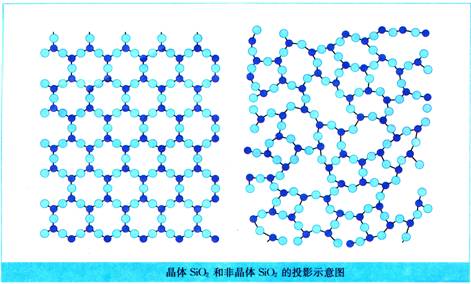
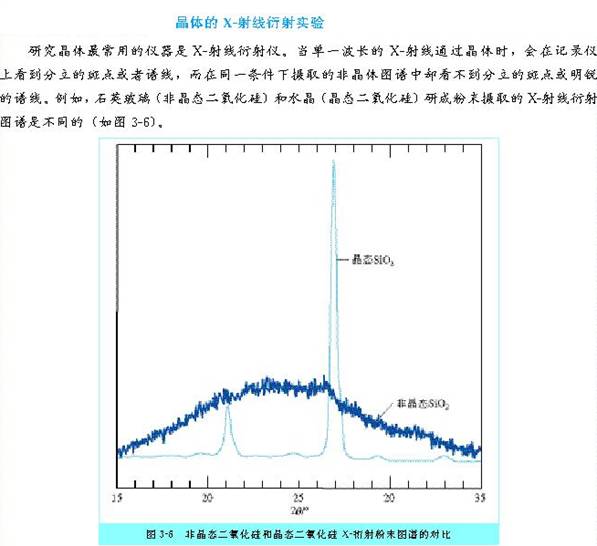
晶体二氧化硅和非晶体二氧化硅在结构上有何不同?
答案:
构成晶体二氧化硅的原子呈现周期性的有序排列,而非晶体二氧化硅中的原子排列则相对无序。
结论:从本质上来说,晶体的自范性是晶体中粒子在微观空间里所呈现周期性的有序排列的宏观表象。而非晶体中粒子的排列则相对无序,因而无自范性。
3、晶体的特点:
(1)宏观有固定的几何外形,微观空间里内部质点排列有高度的有序性;
(2)有固定的熔点;
(3)许多物理性质有各向异性。
解释:
对于晶体来说,许多物理性质:如硬度、导热性、光学性质等,常常会表现出各向异性。例如:在水晶柱上滴一滴融化的石蜡,用一根红热的铁针刺中红热的石蜡,你会发现不同方向石蜡融化的快慢不同,这是由于水晶导热性的各向异性;蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。晶体的某些物理性质的各向异性反映了晶体内部质点的有序性,而非晶体则不具有物理性质各向异性的特点。
注意:可以根据晶体特点区别某一固体属于晶体还是非晶体。然而,区别晶体与非晶体最可靠的方法是利用X-射线衍射实验。
4、晶体的定义:质点(分子、离子、原子)在空间有规则地排列成的,具有规则外型,以多面体出现的固体物质。
思考:
(1)玻璃的结构示意图如下图所示,这张图说明玻璃是不是晶体?为什么?
答案:
晶体与非晶体的本质区别在于构成固体中的粒子在微观空间里是否呈现周期性的有序排列,构成玻璃的粒子无周期性的排列,是无序的,所以玻璃是非晶体。
(2)根据晶体物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举出一些可能有效的方法鉴别假宝石吗?
答案:
利用晶体与非晶体的性质差异来鉴别玻璃和宝石,宝石是晶体,具有固定的熔点和各向异性,可利用硬度、熔点、折光率等性质来鉴别宝石。
①可观察宝石的形状,具有多面体的外形,实验它的硬度,可在玻璃上划出痕迹,初步确定它是宝石。
②可利用宝石的折光率鉴别。
③可用X-射线衍射仪鉴别。
二、晶胞
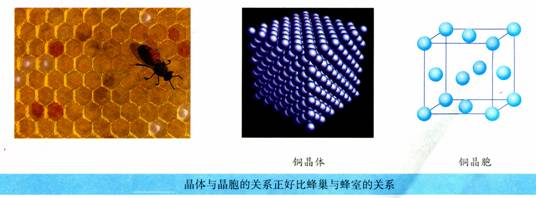
1、晶胞的概念:晶体结构中最小的重复单位。
(1)晶胞都是平行六面体。整块晶体可以看作是由无数个晶胞经过“无隙并置”而成的。所谓“无隙” 是指相邻晶胞之间没有任何间隙。所谓“并置”是指所有晶胞都是平行排列的,取向相同。
(2)同一种晶体所有的晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
(3)晶胞是8个顶点相同的最小平行六面体;晶胞的平行棱相同;晶胞的平行面相同。
2、晶胞中原子个数的计算方法
思考:
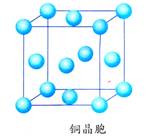
下图是金属铜的一个晶胞,它是一个立方体,从图中我们看到有14个铜原子,金属铜的一个晶胞中是否就含有14个铜原子呢?
答案:
所有晶胞都是平行六面体,晶体可以看作是晶胞在三维空间里共面堆积而成。每个晶胞的上、下、左、右、前、后共有六个与之共面的晶胞。
通过计算可算出金属铜的一个晶胞里含有的铜原子数。
金属铜的一个晶胞的原子数=8×
+6×
=4。
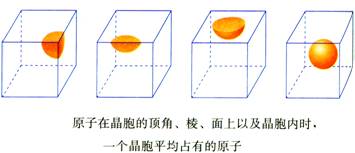
小结:一个晶胞中平均含有
(1)处于晶胞顶点的粒子,同时为8个晶胞所共有,每个粒子只有1/8属于晶胞;
(2)处于棱上的粒子,同时为4个晶胞所共有,每个粒子只有1/4属于晶胞;
(3)处于面上的粒子,同时为两个晶胞所共有,每个粒子只有1/2属于晶胞;
(4)处于晶胞内部的粒子,完全属于该晶胞。
思考:
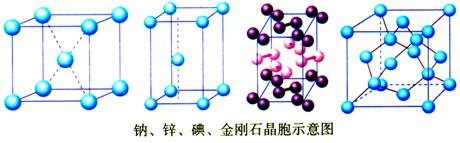
下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子?
答案:
钠:8×
+1=2 锌:8×
+1=2
碘:2×(8×
+6×
)=8 金刚石:8×
+6×
+4=8
典型例题:
1.下列关于晶体与非晶体的说法正确的是( )
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
答案:C。
2.区别晶体与非晶体最可靠的科学方法是( )
A.熔沸点 B.硬度
C.颜色 D.X-射线衍射实验
答案:D。
3.下列不属于晶体的特点是( )
A.一定有固定的几何外形 B.一定有各向异性
C.一定有固定的熔点 D.一定是无色透明的固体
答案:D。
4.下列过程不可以得到晶体的有( )
A.对NaCl饱和溶液降温,所得到的固体
B.气态H2O冷却为液态,然后再冷却成的固态
C.熔融的KNO3冷却后所得的固体
D.将液态的玻璃冷却成所得到的固体
答案:D。
5.晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。晶体的各向异性主要表现在是
①强度 ②导热性 ③导电性 ④光学性质( )
A.①③ B.②④
C.①②③ D.①②③④
答案:D。
6.下图的晶胞中各有几个原子?
答案:
8×
+6×
=4 8×
+6×
+4=8 3×(8×
+6×
)=12
7.下图的碘晶体中碘分子的排列有几种不同的方向?
答案:2种。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -