| 分子晶体 |
主编:黄冈中学化学集体备课组
思考:
冰、干冰、碘晶体都属于分子晶体,构成它们的粒子是什么?这些粒子间通过什么作用结合而成晶体?
答案:
构成它们的粒子是分子,分子间以分子间作用力相结合而构成分子晶体。
1、概念:只含分子的晶体称为分子晶体,即分子间以分子间作用力相结合的晶体叫做分子晶体。
要从以下几个方面理解分子晶体:
(1)构成粒子:分子。
(2)粒子间相互作用:分子间作用力(范德华力)。
注意:在分子晶体中,分子内的原子间以共价键结合,而相邻分子靠分子间作用力相互吸引。
思考:
分子晶体的物理性质有哪些特点呢?
答案:
由于在分子晶体中,相邻分子靠分子间作用力相互吸引。所以分子有低熔点、升华的特性,且分子晶体的硬度很小。
某些分子晶体的熔点
分子晶体 |
氧 |
氮 |
白磷 |
水 |
硫化氢 |
甲烷 |
乙酸 |
尿素 |
熔点/℃ |
-218.3 |
-210.1 |
44.2 |
0 |
-85.6 |
-182.5 |
16.7 |
132.7 |
(3)物理性质:熔、沸点低,易升华,硬度小。固体和熔融状态时都不导电,但有的分子晶体溶于水后其水溶液能导电。
(4)较典型的分子晶体有:
①非金属氢化物,如水、硫化氢、氨、氯化氢、甲烷,等等;
②部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60)、稀有气体,等等;
③部分非金属氧化物,如CO2、P4O6、P4O10、SO2,等等;
④几乎所有的酸;
⑤绝大多数有机物。
思考:
(1)是否所有的分子晶体中都存在共价键?
答案:
不是,稀有气体为分子晶体,由单原子分子构成,不含共价键。
(2)分子晶体的熔沸点高低如何比较?
答案:
分子间作用力越大,分子晶体熔沸点越高。
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,分子晶体的熔沸点越高。但是有些氢化物由于分子间存在氢键它们的熔点和沸点的递变却与此不完全符合,如:NH3、H2O和HF的沸点就出现反常。
2、分子晶体的结构特征

注意:这四种分子晶体中分子间作用力只是范德华力。
思考:
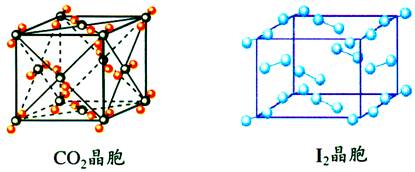
(1)干冰晶体的晶胞中CO2分子及碘晶胞中I2分子的位置如何?
答案:
在顶点和面心处(面心晶胞),氧(O2)和碳60(C60)晶体的晶胞中分子的位置也在顶点和面心处。
(2)在干冰晶体中与CO2分子距离最近且等距离的CO2分子的数目有多少个?
答案:
12个。
判断方法一:假若选定立方体顶点上的一个CO2分子,则与其等距离最近的CO2分子应在面心上,这样的分子共有12个(同层4个,上层4个,下层4个),且距离为
a。
判断方法二:把一个CO2分子移致体心,再作判断。
注意:碘(I2)、氧(O2)和碳60(C60)晶体中每一个分子周围通常也有12个紧邻的分子。
(1)分子晶体中分子间作用力只是范德华力:晶体中每一个分子周围通常有12个紧邻的分子,为分子密堆积结构。(面心晶胞)
提问:如果分子晶体中分子间除范德华力外还有其他作用力(如氢键),如果分子间存在着氢键,分子是否也采取紧密堆积的方式?
答案:
如果分子间存在着氢键,分子就不会采取紧密堆积的方式。
(2)分子晶体中分子间作用力主要是氢键:晶体结构不为分子密堆积结构,如冰。
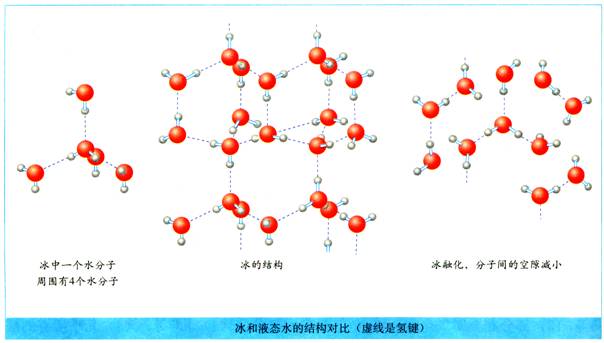
在冰的晶体中,每个水分子周围只有4个紧邻的水分子,形成四面体。冰晶体结构不为分子密堆积结构。
氢键不是化学键,比共价键弱得多,却跟共价键一样具有方向性,而氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子的相互吸引,这一排列使冰晶体中空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4°C时,由于热运动加剧,分子间距离加大,密度逐渐减小。
思考:干冰与冰的密度比较,哪个大?
答案:
干冰晶体中,CO2分子之间只存在范德华力不存在氢键,一个分子周围有12个紧邻分子。冰晶体中,水分子之间分子间作用力主要是氢键,每个水分子周围只有4个紧邻的水分子,分子间空隙比干冰的大,因而干冰的密度比水的大。
讨论:取两块大小相同的干冰,在一块干冰中央挖一个小穴,撒入一些镁粉,用红热的铁棒把镁粉点燃,将另一块干冰盖上,会看到镁粉在干冰内继续燃烧,像冰灯中装进一个电灯泡一样,发出耀眼的白光。这个实验证明了哪些事实?
答案:
证明金属镁可以跟二氧化碳反应:2Mg + CO2
2MgO + C,也说明了干冰易升华的特性。
典型例题:
1、下列属于分子晶体的一组物质是( )
A .CaO、NO、CO B. CCl4、H2O2、He
C. CO2、SO2、NaCl D. CH4、O2、Na2O
答案:B
2、下列性质符合分子晶体的是( )
A.熔点1070℃,易熔于水,水溶液能导电
B.熔点是10.31℃,液体不导电,水溶液能导电
C.熔点97.81℃,质软,能导电,密度是0.97g/cm3
D.熔点970℃,熔化时能导电,水溶液也能导电
答案:B
3、下列物质的液体中,不存在分子是( )
A.二氧化硅 B.二氧化硫
C.二氧化碳 D.二硫化碳
答案:A
4、下列说法正确的是( )
A. 离子化合物中可能含有共价键
B. 分子晶体中的分子内不含有共价键
C. 分子晶体中一定有非极性共价键
D. 分子晶体中分子一定紧密堆积
答案:A
5、干冰汽化时,下列所述内容发生变化的是( )
A. 分子内共价键 B. 分子间作用力
C. 分子间距离 D. 分子间的氢键
答案:BC
6.四氯化硅的分子结构与四氯化碳类似,对其作出如下推测
①四氯化硅晶体是分子晶体。②常温常压四氯化硅下是液体。③四氯化硅分子是由极性键形成的分子。④四氯化硅熔点高于四氯化碳。
其中正确的是( )
A.只有① B.只有①②
C.只有②③ D.①②③④
答案:D
7、“可燃冰”是深藏在海底的白色晶体,存储量巨大,是人类未来极具潜在优势的洁净能源。在高压低温条件下,由水分子形成空间笼状结构,笼中“关”甲烷而形成,如某种可燃冰的存在形式为CH4·5.75H2O。
(1)“可燃冰” CH4·5.75H2O的分子中,m(CH4)∶m(H2O)=。
(2)若要从“可燃冰”中分离出甲烷,可用下列两中方法:①在一定温度下,使气体从水合物中分离出来,在一定压力下,使气体从水合物中分离出来。
答案:
(1)1: 6.5;(2)降压;加热。
8、选择以下物体填写下列空白
A.干冰 B.氯化铵
C.烧碱 D.固体碘
(1)晶体中存在分子的是__________(填写序号,下同)。
(2)晶体中既有离子键又有共价键的是__________。
(2)熔化时不需要破坏共价键的是__________。
(2)常况下能升华的是__________。
答案:(1)AD;(2)BC;(3)ABCD;(4)AD
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -