|
一、选择题
1.下列物质呈固态时,一定属于分子晶体的是( )
A.非金属单质 B.非金属氧化物
C.含氧酸 D.金属氧化物
2.分子晶体具有的本质特征是( )
A.组成晶体的基本构成粒子是分子
B.熔融时不导电
C.晶体内粒子间以分子间作用力相结合,这种作用很弱
D.熔点一般比较低
3.干冰熔点很低是由于( )
A.CO2是非极性分子 B.C=O键的键能很小
C.CO2化学性质不活泼 D.CO2分子间的作用力较弱
4.下列属于分子晶体的一组物质是( )
A.CaO、NO、CO B.CCl4、H2O2、He
C.CO2、SO2、NaCl D.CH4、O2、Na2O
5.下列性质最符合分子晶体的性质的是( )
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液体不导电,水溶液能导电
C.熔点97.81℃,质软,能导电,密度是0.97g/cm3
D.熔化时能导电,水溶液也能导电
6.下列说法正确的是( )
A.分子晶体中可能含有共价键
B.分子晶体中的分子内不可能含有共价键
C.分子晶体中一定有非极性共价键
D.分子晶体中分子一定紧密堆积
7.下列物质的液体中,不存在分子的是( )
A.二氧化硅 B.二氧化硫
C.二氧化碳 D.二硫化碳
8.为缓解北京地区的旱情,有关部门选择适宜的条件和方法,向大气中发射催雨剂,其主要成分是干冰(固态CO2)、液氮、碘化银等。下列有关叙述不正确的是( )
A.干冰和液氮都是由分子构成的晶体
B.干冰和液氮的分子中都有非极性共价键
C.干冰和液氮催雨的原理都属于物理变化
D.碘化银粒在冷云中产生冰晶,起到催雨作用
9.CO2晶体中具有相同的距离的CO2分子数最多为( )
A.12 B.8
C.6 D.4
10.乙醇易溶于水中,这可以用以下的理由解释( )
A.相似相溶
B.乙醇分子与水易形成氢键
C.乙醇分子与水之间形成了化学键
D.两者的晶体类型相同
二、填空题
11.选择以下物质填写下列空白:
A.干冰 B.氯化铵 C.烧碱 D.固体碘
(1)晶体中存在分子的是__________(填写序号,下同)。
(2)晶体中既有离子键又有共价键的是__________。
(3)熔化时不需要破坏化学键的是__________。
(4)常温下能升华的是__________。
显示答案
|
11.(1)AD;(2)BC;(3)AD;(4)A |
12.已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃和常压下即开始升华。
(1)氯化铝是__________晶体(填“离子”或“分子”)。
(2)在500℃,1.01×105Pa时,氯化铝的蒸气密度(换算成标准状况)为11.92g·L-1,且已知它的结构中还含有配位键,氯化铝的化学式为__________。
(3)设计一个更可靠的实验,证明氯化铝是离子晶体还是分子晶体,你的实验是______________________________。
显示答案
|
12.(1)分子;
(2)
(3)在加压条件下加热至熔融,测其导电性,若导电,则是离子晶体,若不导电,则为分子晶体 |
13.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1∶2。
请回答:
(1)组成A分子的原子的元素符号是__________;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是______________________________。
(2)C的立体结构呈____________________形,该分子属于__________(填“极性”或“非极性”)分子。
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为____________________(不需要写反应条件)。
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。根据下表数据,说明CO比N2活泼的原因是______________________________。
|
|
A—B |
A=B |
A≡B |
CO |
键能(kJ/mol) |
357.7 |
798.9 |
1071.9 |
键能差值(kJ/mol) |
441.2 273 |
N2 |
键能(kJ/mol) |
154.8 |
418.4 |
941.7 |
键能差值(kJ/mol) |
263.6 523.3 |
(5)它们的分子中都包含__________个σ键,个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。Ni原子的价电子排布式为__________。Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于__________(填晶体类型);Fe(CO)5是配合物,配体是__________。
显示答案
|
13.(1)Ar; E是CH3OH,CH3OH形成分子间氢键
(2)V(或角或其他合理答案);极性
(3)N2O4+2N2H4=3N2+4H2O
(4)CO中第一个π键的键能比N2的小很多,CO的第一个键容易断
(5)1;2
(6)3d84s2;分子晶体;CO |
14.(1)下列现象和应用与电子跃迁无关的是__________。
A.激光 B.焰色反应
C.燃烧放热 D.原子光谱
E.霓虹灯 F.石墨导电
(2)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子。
①某直线形分子由A、B两种元素组成且原子个数比为1∶1,该分子中含有__________个σ键,__________个π键。
②由A、B、C三种元素组成的无机阴离子,可形成二聚离子或多聚链状离子,从该阴离子的结构特点分析能够相互缔合的原因:________________________________________。
(3)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①基态28Ni原子的核外电子排布式为____________________。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)______________________________。
显示答案
|
14.(1)CF
(2)①3;2;
②HCO3-中含有O—H键,相互之间可通过O—H…O氢键缔合
(3)①1s22s22p63s23p63d84s2;②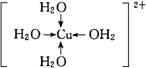 |
|