例1、(海南)下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
|
表述Ⅰ |
表述Ⅱ |
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
解析:
A选项中,NaCl溶于水是离子晶体的特性,I2是非极性分子溶解度小;B选项中分子的稳定性与键能有关,所以正确;C中形成化合物不一定是最高价或最低价,所以不与最外层电子数呈因果关系;D选项因P4O10发生了反应,所以不能证明P4O10是共价化合物。
答案:B
例2、(全国卷I)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水溶液是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是____________;
(2)Q的具有相同化合价并且可以相互转变的氧化物是___________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是___________;
(4)这5种元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)___________,其原因是___________;②电子总数相同的氢化物的化学式和立体结构分别是___________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是___________。
解析:
W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化物的水化物为强酸,且与Si、N等相邻,则Y只能是S,所以R的最高价化合物应为As2S5。(4)显然X为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18,结构分别为正四面体、三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
答案:
(1)原子晶体
(2)NO2和N2O4
(3)As2S5
(4)①NH3>AsH3>PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体、三角锥和V形。
(5)SiCl4+4NH3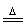 Si(NH2)4+4HCl,3Si(NH2)4
Si(NH2)4+4HCl,3Si(NH2)4 8NH3+Si3N4
8NH3+Si3N4
例3、(宁夏)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为___________,该元素的符号是___________;
(2)Y元素原子的价层电子的轨道表示式为___________,该元素的名称是___________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由__________。
解析:
(1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;(2) Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H.
答案:
(1)1s22s22p63s23p63d104s24p3;As
(2)
(3)三角锥
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
(5)稳定性:NH3>PH3>AsH3;因为键长越短,键能越大,化合物越稳定沸点:NH3>AsH3>PH3; NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。