| 原子晶体 |
主编:黄冈中学化学集体备课组
思考:
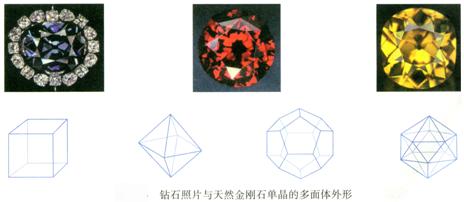
C、Si同属ⅣA元素,且上下相邻,应具相似的性质。今已知CO2的晶体为分子晶体,熔、沸点很低。那么SiO2晶体是否具有与其相似的结构和性质呢?
CO2和SiO2一些性质的比较
分析:
两者相比,性质差异很大。由SiO2有很高的熔、沸点,可推知它不属于分子晶体。其质点粒子不是分子。那它是什么晶体呢?
从其元素组成和化合物类别看,SiO2不是离子化合物。它属于另一类晶体即原子晶体。
思考:
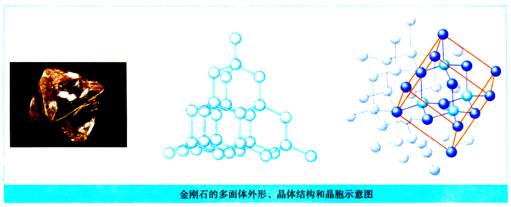
(1)金刚石为原子晶体,构成金刚石晶体的粒子是什么?
构成金刚石晶体的粒子碳原子。
(2)金刚石晶体中粒子通过何种方式结合?怎样构成晶体?
金刚石中的每个碳原子都取sp3杂化轨道以四个共价单键对称地与相邻的4个碳原子结合,C—C键长相等(154pm),C—C—C夹角均为109°28′,呈正四面体结构,这些正四面体结构向空间发展,构成彼此连接的立体网状晶体。
1、概念:相邻原子间以共价键相结合而形成的空间网状结构的晶体。
要从以下几个方面理解分子晶体:
(1)构成粒子:原子。
(2)粒子间相互作用:共价键。
注意:在原子晶体中,所有原子都以共价键相互结合,整快晶体是一个三维的共价键网状结构,是一个“巨分子”,又称共价晶体。
思考:
根据金刚石晶体结构特点,请推测金刚石的硬度大小,熔沸点高低?
金刚石里C—C共价键的键长(154pm)很短,键能(347.7kJ/mol)很大,这一结构使金刚石在所有已知晶体中硬度最大,且熔点也很高。高硬度、高熔点是原子晶体的特征。
(3)物理性质:熔、沸点高,硬度大,一般不导电(Si为半导体),难溶于常见溶剂。
思考:
为什么原子晶体的熔、沸点很高,硬度很大呢?
究其本质是因为原子晶体中原子通过很强的共价键连接,由于共价键比较牢固,要拆开它需要消耗较大的能量,所以原子晶体一般具有较高的熔、沸点和较大的硬度。
思考:
为什么原子晶体一般不导电?
原子晶体由中性原子通过牢固的共价键结合而成,晶体中不含离子和自由电子,所以一般不导电。
(4)常见的原子晶体有:
①某些非金属单质,如金刚石、B、Si、Ge等;
②某些非金属化合物,如SiO2、SiC、BN等。
2、几种重要的原子晶体
(1)金刚石:
①晶体结构:正四面体结构彼此连接的立体网状结构。
②晶胞结构:顶点和面心各有1个C原子;晶胞体内有4个C原子,位于互不相邻的4个顶点C原子及其相邻的3个面心C原子构成的正四面体中心。
注意:在金刚石晶胞中,有8个四面体空隙和4个八面体空隙,8个四面体空隙中有4个被碳原子占有。
思考:
①在金刚石晶体中,每个C原子与多少个原子C成键?形成怎样的空间结构?最小碳环由多少个C原子组成?含有多少个C—C键?组成最小碳环的所有C原子是否在同一平面内?
在金刚石晶体中,每个C原子与4个C原子成键,形成正四面体型空间网状结构。最小碳环由6个C原子组成,含有6个C—C键,组成最小碳环的所有C原子不在在同一平面内。
②在金刚石晶体中,C原子个数与C—C键数之比为多少?
1∶4×
=1∶2。
③12g金刚石中含C—C键数为多少NA?
C原子个数与C—C键数之比为1∶2,12g金刚石为1mol,含C—C键2mol,故C—C键数为2NA。
(2)SiO2
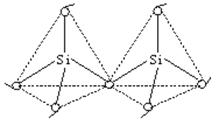
构成SiO2晶体的粒子是中性原子,原子与原子间以共价键相结合。在SiO2晶体中,1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。许许多多的[SiO4]正四面体通过氧原子互相联结形成一种空间网状结构的原子晶体。
①晶体结构:[SiO4]正四面体通过氧原子互相联结形成的空间网状结构。
思考:
a. 观察SiO2晶体结构,那么晶体中存在SiO2的小分子吗?“SiO2”表示什么?
SiO2晶体中,Si、O原子通过共价键相结合,形成一个由“无限”数目原子构成的空间网状结构。由于在各个方向上这种共价键是相同的,因此在晶体中,不存在独立的小分子,而只能把整个晶体看成一个大分子。晶体有多大,分子也就有多大,没有确定的分子量。这跟CO2晶体中的小分子是不同的。那么,“SiO2”自然不叫分子式了。它只表示晶体中Si原子和O原子的个数比,为晶体的化学式。
b.SiO2晶体中Si—O键的键角是多少?每个正四面体占有的Si、O原子数是多少?
Si、O原子通过共价键连成正四面体结构,Si原子位于正四面体中心,Si—O键角为109°28′。每个正四面体占有一个完整的Si、四个“半O原子”,故晶体中Si原子与O原子个数比为1∶(4×
)=1∶2,晶体化学式为“SiO2”。
c.在SiO2晶体中,最小环由多少个Si和O原子组成?含有多少个Si—O键?
最小环由6个Si和6个O原子组成,含有12个Si—O键。
d.在SiO2晶体中,Si原子个数与Si—O键数之比为多少?
1∶4
②纯净的SiO2晶体:水晶。
纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。江苏省东海县素有“水晶之乡”之称。1958年在该县发现我国最大的“水晶王”,质量达3.5 t。1983年1月又在该县南溜村2 m深的地下挖出一块质量为3 t高为1.4 m的水晶,同时出土的还有一块质量为400 kg的水晶体。
③用途:水晶除可用于漂亮的装饰品外,还常用于制造精密仪器轴承,耐磨器皿和耐高温化学仪器。SiO2可用来制造用于光纤通迅等的光导纤维,制造压电晶体,用于钟表工业和超声技术上。此外,SiO2还是制造水泥、玻璃、单晶硅、硅光电池、芯片的原料。

思考:
同为结构相同的原子晶体,为什么金刚石比晶体Si的熔、沸点高?
原子晶体熔、沸点高是因共价键键能大,而键能的大小又主要取决于原子半径的大小即键长的长短。在此,由于原子半径C<Si,所以C—C键长<Si—Si键长,C—C键能>Si—Si键能,熔、沸点金刚石>晶体Si。
3、原子晶体熔沸点高低、硬度比较
对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,晶体的熔沸点越高,硬度越大。
思考:
(1)已知金刚砂即碳化硅(SiC)质地坚硬,常用作优质磨料。其结构和金刚石相似,只是碳的骨架结构中有一半位置被Si原子所取代,形成C—Si交替的空间网状结构。金刚砂属于什么晶体?其熔、沸点与金刚石、晶体Si相比高低顺序如何?
据金刚砂的结构和性质不难推断为原子晶体。而其熔、沸点与金刚石、晶体Si相比高低如何,只需比较C—C、C—Si、Si—Si键的键能即可。通过比较C、Si原子半径,不难得出键能:C—C>C—Si>Si—Si,所以熔、沸点为金刚石>碳化硅>晶体Si。
(2)怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
由于金刚石、硅和锗的晶体都是原子晶体,形成晶体的粒子均为原子,粒子间的相互作用是共价键,所以熔、沸点和硬度的大小由共价键的强弱决定。由于碳、硅、锗三种原子的半径依次增大,各个原子间的共价键的键长依次增大,键的强度依次减弱,所以金刚石、硅和锗的熔点和硬度依次下降。
(3)“具有共价键的晶体叫原子晶体”。这种说法对吗?为什么?
此说法不对。“具有共价键”并不是原子晶体判定的唯一条件,分子晶体的分子内部也有共价键,如冰和干冰都是分子晶体,但H2O和CO2中存在共价键。对原子晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
典型例题:
1.下列晶体中不属于原子晶体的是( )
A.干冰 B.金刚砂
C.金刚石 D.水晶
答案:A。
2.下列各物质中,按熔点由低到高排列正确的是( )
A.O2、I2、Hg B.CO2、K、SiO2
C.Na、K、Rb C. SiC、NaCl、SO2
答案:B。
3.下列各晶体中任意一个原子都被相邻的4个原子所包围;以共价键结合成正四面体结构,并向空间伸展成网状结构的是( )
A.甲烷 B.石墨
C.晶体硅 D.水晶
答案:CD。
4.在x mol石英晶体中,含有Si-O键数是( )
A.x mol B.2x mol
C.3 x mol D.4x mol
答案:D。
5.固体熔化时,必须破坏非极性共价键的是( )
A.冰 B.晶体硅
C.溴 D.二氧化硅
答案:B。
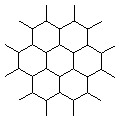
6.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是 ( )
A.10个 B.18个
C.24个 D.14个
答案:D。
7.石英玻璃是将纯石英在1600℃高温下熔化,冷却后形成的玻璃体。关于石英玻璃的结构和性质的叙述中正确的是( )
A.石英玻璃属于原子晶体
B.石英玻璃耐高温且能抵抗一切酸的腐蚀
C.石英玻璃的结构类似于液体
D.石英玻璃能经受高温剧变且能抗碱的腐蚀
答案:BC。
8.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
答案:D。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -