|
一、选择题
1.构成原子晶体的粒子及作用力是( )
A.原子、共价键 B.分子、共价键
C.原子、分子间作用力 D.分子、分子间作用力
2.下列的晶体中,化学键种类相同,晶体类型也相同的是( )
A.SO2与SiO2 B.CO2与H2O
C.C与HCl D.CCl4与SiC
3.固体熔化时必须破坏非极性共价键的是( )
A.冰 B.晶体硅
C.溴单质 D.二氧化硅
4.第三周期元素形成的单质中,属于原子晶体的是( )
A.金刚砂 B.金刚石
C.单晶硅 D.二氧化碳
5.碳化硅(SiC)是一种具有类似金刚石结构的晶体,其中C原子和Si原子的位置是交替的。在下列三种晶体:①金刚石;②晶体硅;③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
6.1999年姜国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断中不正确的是( )
A.原子晶体干冰有很高的熔点、沸点,有很大的硬度
B.原子晶体干冰易气化,可用作制冷材料
C.原子晶体干冰的硬度大,可用作耐磨材料
D.每摩尔原子晶体干冰中含4mol C—O键
7.石英玻璃是将纯石英在1600℃高温下熔化,冷却后形成的玻璃体。关于石英玻璃的结构和性质的叙述中正确的是( )
A.石英玻璃属于原子晶体
B.石英玻璃耐高温且能抵抗一切酸的腐蚀
C.石英玻璃的结构类似于液体
D.石英玻璃能经受高温剧变且能抗碱的腐蚀
8.下列说法正确的是( )
A.124g P4含有的P—P键的个数为6NA
B.12g石墨中含有的C—C键的个数为2NA
C.12g金刚石中含有的C—C键的个数为1.5NA
D.60g SiO2中含Si—O键的个数为2NA
9.下列叙述中正确的是( )
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.原子晶体中,构成晶体的粒子一定是相同的原子
10.下列说法中错误的是( )
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
11.在金刚石晶体的网状结构中,含有共价键形成的碳原子环,其中最小的碳环中的碳原子数和C—C键之间的夹角是( )
A.6个,120° B.6个,109.5°
C.5个,109.5° D.5个,120°
二、填空题
12.单质硼有无定形和晶体两种,参考下表数据回答:
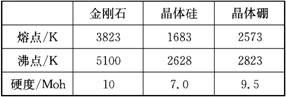
(1)晶体硼的晶体类型属于__________晶体,理由是____________________________。
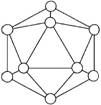
(2)已知晶体硼的结构单元是由硼原子组成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由__________个硼原子构成的,其中B—B键的键角为__________,共含有__________个B—B键。
显示答案
|
12.(1)原子;熔点高,硬度大,并且各数据均介于金刚石和晶体硅之间
(2)12 ; 60°; 30
解析:三个硼构成平面三角形,故键角为60°,用分摊法计算,晶体硼单元有20个面,每个面上有3个硼原子,每个硼原子又被5个面分,故晶体硼单元中的硼原子数:20×3/5=12,故有12个顶点,同理边数计算方法为:晶体硼单元有20个面,每个面上有3个边,每个边被两个面分,故晶体硼单元中B—B键有20×3/2=30条。 |
13.请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有__________种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为____________________。在GaN晶体中,每个Ga原子与__________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为__________。在四大晶体类型中,GaN属于__________晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是____________________(填化学式)。
显示答案
|
13.(1)5
(2)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);4;正四面体;原子
(3)HClO、NH3·H2O
解析:(1)前四周期中,基态原子中未成对电子数与其周期数相同的元素包括:第一周期的氢、第二周期的碳和氧、第三周期的磷、第四周期的铁,共5种。
(2)Ga在元素周期表中是第四周期、第ⅢA族,原子序数是31,即其原子核外电子数是31,根据核外电子的排布规律可以写出该原子的电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1。因为GaN晶体结构与单晶硅相似,可知GaN晶体是原子晶体,晶体结构为空间网状结构,每个Ga原子与四个N相连,这四个N原子构成的空间构型是正四面体形。
(3)水解反应前后各元素的化合价不变,由题意知NCl3中N的化合价为-3价,Cl的化合价为+1价,则在NCl3水解的产物中N的化合价也是-3价,Cl的化合价是+1价,分析可知其水解产物是HClO和NH3·H2O。 |
14.C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为____________________。
(2)按要求指出下列氧化物的空间构型、成键方式或性质:
①CO2分子的空间构型及碳氧之间的成键方式____________________;
②SiO2晶体的空间构型及硅氧之间的成键方式____________________。
(3)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为__________。
显示答案
|
14.(1)1s22s22p63s23p63d104s24p2
(2)①直线形,共价键(或σ键与π键);②通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,共价键(或σ键)
(3)配位键 |
15.请根据二氧化硅的晶胞结构示意图回答下列问题:
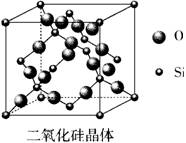
(1)二氧化硅属于__________晶体。硬度__________,熔沸点__________。
(2)二氧化硅中硅原子的杂化方式为__________,每个硅原子与__________个氧原子相连,1mol二氧化硅中含有的Si—O键有__________mol。
(3)在二氧化硅的晶胞中总共有__________个硅原子,__________个氧原子。
显示答案
|
15.(1)原子;大;高
(2)sp3;4;4
(3)8;16 |
|