 例1、(江苏)
例1、(江苏) 生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式____________。
(2)根据等电子原理,写出CO分子结构式____________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
 ①甲醇的沸点比甲醛的高,其主要原因是____________;甲醛分子中碳原子轨道的杂化类型为____________。
①甲醇的沸点比甲醛的高,其主要原因是____________;甲醛分子中碳原子轨道的杂化类型为____________。
②甲醛分子的空间构型是____________;1mol甲醛分子中σ键的数目为____________。
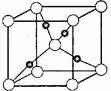
 ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为____________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为____________。
解析:
(1)Zn的原子序数为30,在周期表中位于第四周期、ⅡB族,则其核外电子排布式为:1s22s22p63s23p63d104s2 或[Ar]3d104s2。
(2)根据等电子原理,CO与N2属于等电子体,所以其分子结构相似,由于N2的结构式为N≡N,所以CO也应为C≡O。
(3)①由于醇羟基比醛基容易形成氢键,所以甲醇的沸点高于甲醛;由于甲醛分子结构中每个碳原子只形成三个共价键,则应该是sp2杂化形式。
② 甲醛的结构式为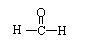 ,所以甲醛的空间构型为平面三角形;甲醛分子中的2个C-H键是σ键,C=O键中的一个键是σ键,另一个则是π键,则一个甲醛分子中有2个σ键,所以1mol甲醛分子中σ键的数目为3NA。
,所以甲醛的空间构型为平面三角形;甲醛分子中的2个C-H键是σ键,C=O键中的一个键是σ键,另一个则是π键,则一个甲醛分子中有2个σ键,所以1mol甲醛分子中σ键的数目为3NA。
③由化学式Cu2O和晶胞模型可知,白球为氧原子,黑色球为铜原子,且铜原子位于晶胞内部,所以1个Cu2O晶胞中包含Cu 原子数目为4个。
 答案:
答案:
(1)1s22s22p63s23p63d104s2 或[Ar]3d104s2
 (2)C
(2)C O(或C
O(或C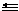 O)
O)
 (3)①甲醇分子之间形成氢键 ; sp2杂化
(3)①甲醇分子之间形成氢键 ; sp2杂化
②平面三角形; 3NA
③4
例2、(四川)下列说法中正确的是( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
解析:
离子晶体中阴阳离子排列的方式不同,某个离子吸引带相反电荷的离子的个数也不同。如NaCl为6个;CsCl为8个。故A错。没有外加电场的条件下,金属晶体中就存在自由电子,这也是金属导电、导热的根本原因。B错。一般来说分子晶体有低熔点、低沸点的物理性质。但在常温下不一定均为液态或固态。如I2、P、S等在常温下为固态,C错。原子晶体就是原子间以共价键相结合形成空间网状结构的固体。
答案:D
例3、(上海)判断下列有关化学基本概念的依据正确的是( )
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
解析:
只含共价键的化合物是共价化合物,而单质也可以有共价键,如氯气,故B错;强弱电解质的判断依据是在水溶液中的电离程度,而非导电性,溶液的导电能力与溶液中可自由移动离子浓度及离子所带电荷数有关,强电解质的稀溶液导电性也可能会很弱,而弱电解质的浓溶液导电性也可能会较强,故C错。某些非金属晶体也可导电,如:石墨、硅等,故D错。
答案:A