1.金属晶体的形成是因为晶体中存在( )
①金属原子 ②金属离子 ③自由电子 ④阴离子
A.只有① B.只有③
C.②③ D.②④
2.金属键是正、负电荷之间的( )
A.相互排斥 B.阴、阳离子之间的相互作用
C.相互吸引 D.相互排斥和相互吸引,即相互作用
3.金属具有的通性是( )
①具有良好的导电性 ②具有良好的传热性 ③具有延展性
④都具有较高的熔点 ⑤通常状况下都是固体 ⑥都具有很大的硬度
A.①②③ B.②④⑥
C.④⑤⑥ D.①③⑤
4.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
5.下图是金属晶体内部的电气理论示意图,仔细观察并用电气理论解释金属导电的原因是( )
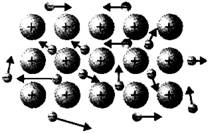
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有电子且无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
6.金属晶体的熔沸点之间的差距是由于( )
A.金属键的强弱不同
B.金属的化合价的不同
C.金属的晶体中电子数的多少不同
D.金属的阳离子的半径大小不同
7.金属晶体能传热的原因( )
A.因为金属晶体的紧密堆积
B.因为金属键是电子与电子之间的作用
C.金属晶体中含自由移动的电子
D.金属晶体中的自由移动的阳离子
8.下列物质的熔沸点依次升高的是( )
A.K、Na、Mg、Al B.Li、Na、Rb、Cs
C.Al、Mg、Na、K D.C、K、Mg、Al
9.下列有关金属元素特征的叙述中正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质在常温下都是固体
10.在下列有关晶体的叙述中错误的是( )
A.分子晶体中,一定存在极性共价键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体
11.下列有关金属晶体叙述正确的是( )
A.常温下金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点低于钾
D.温度越高,金属的导电性越好
12、氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如下图所示。则这种合金的化学式为( )
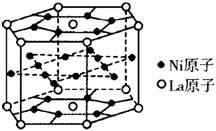
A.LaNi3 B.LaNi4
C.LaNi5 D.LaNi6
14.理论预测以下物质的物理性质,用“>”、“=”或“<”填空:
(1)CS2的沸点__________CO2的沸点。
(2)Cs的熔点__________K的熔点。
(3)金属K的硬度__________金属Ca的硬度。
(4)金刚石的硬度__________晶体硅的硬度。
(5)铝硅合金在凝固时收缩率很小,因而这种合金适合铸造。在①铝,②硅,③铝硅合金三种晶体中,它们的熔点从低到高的顺序是__________。
15.晶体是质点(分子、离子或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质。在空间里无限地周期性地重复能成为晶体的具有代表性的最小单元,称为晶胞。一种Al—Fe合金的立体晶胞如图所示。
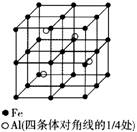
(1)确定该合金的化学式__________。
(2)若晶胞的边长为a nm,则此合金的密度为__________g/cm3。
(3)取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72L。过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L。(气体体积均在标准状况下测定)
①计算硝酸的物质的量浓度__________。
②最终所得溶液中Fe3+的物质的量浓度__________(假设溶液体积仍为100mL)。