| 金属原子堆积模型 |
主编:黄冈中学化学集体备课组
思考:
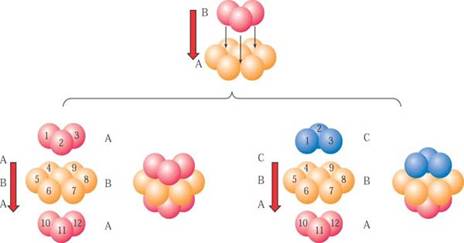
利用大小相同的玻璃小球,有序地排列在水平桌面上(二维平面上),要求小球之间紧密接触。可能有几种排列方式。
主要有以下两种方式:

1、金属原子在二维平面里排列的方式
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(二维空间),可有两种方式:
思考:
两种排列方式的配位数(配位数:同一层内与一个原子紧密接触的原子数)分别是多少?哪一种排列方式空间利用率更高?
非密置层,配位数4;密置层,配位数6。密置层空间利用率更高。
2、金属原子在三维空间里的堆积方式
将非密置层一层一层地在三维空间里堆积,有两种方式:
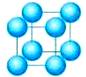
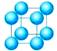
(1)简单立方堆积
这种堆积方式形成的晶胞是一个立方体,每个晶胞含1个原子,被称为简单立方堆积。这种堆积方式的空间利用率太低(最低),只有金属钋采取这种堆积方式。
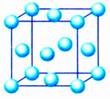
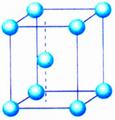
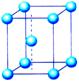
(2)体心立方堆积
非密置层上层金属原子填入下层的金属原子形成的凹穴中,并使非密置层原子稍稍分离,每层均照此堆积,就形成非密置层的第二种三维空间堆积方式。
金属晶体的堆积方式——体心立方堆积
这种堆积方式所得到的晶胞是一个含有两个原子的立方体,一个原子在立方体的顶点,另一个原子在立方体的中心,成为体心立方堆积。这种堆积方式的空间利用率显然比简单立方堆积的高多了,许多金属是这种堆积方式,如碱金属。
思考:体心立方堆积的晶胞是个立方体。如果原来的非密置层上的原子保持紧密接触,立方体中心能否容得下一个原子?
如果原来的非密置层上的原子保持紧密接触,形成的空隙半径太小,不能再容纳一个等径的原子。
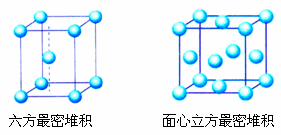
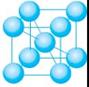
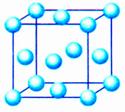
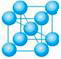
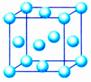
(3)六方最密堆积和面心立方最密堆积
密置层的原子按体心立方堆积方式堆积,会得到两种基本堆积方式:
①六方最密堆积:如图左侧,按ABABABAB……的方式堆积;
②面心立方最密堆积:如图右侧,按ABCABCABC……的方式堆积。
这两种堆积方式都是金属晶体的最密堆,配位数均为12,空间利用率均为74℅,但所得的晶胞的形式不同。
六方最密堆积和面心立方最密堆积的晶胞:
六方最密堆积面心立方最密堆积
思考:金属晶体的四种堆积方式原子的空间利用率多大,如何计算?
(1)首先把堆积方式抽象成晶胞模型;
(2)均摊法计算晶胞的微粒个数,计算微粒所占的体积;
(3)计算晶胞的总体积;
(4)空间利用率等于结构粒子总体积比晶胞总体积。
①简单立方:
设原子半径为r,晶胞边长为a,则a=2r。有
晶胞体积V(晶胞)=a3=8r3
一个晶胞中原子数为1,原子的总体积V(原子)=
空间利用率为V(原子)/ V(晶胞)=
/8r3=0.52=52%
②体心立方:
设原子半径为r,晶胞边长为a,则晶胞体对角线长为4r。有
a=4r, a=
r 晶胞体积V(晶胞)=a3=
r3
一个晶胞中原子数为2,原子的总体积V(原子)=2×
=
空间利用率为V(原子)/ V(晶胞)=
/
r3=0.68=68%
③面心立方:
设原子半径为r,晶胞边长为a,则晶胞面对角线长为4r。有
a=4r,a=
r 晶胞体积V(晶胞)=a3=
r3
一个晶胞中原子数为4,原子的总体积V(原子)=4×
=
空间利用率为V(原子)/ V(晶胞)=
/
r3=0.74=74%
④六方最密堆积:
设原子半径为r,晶胞上下底边长为a,高为h,则a=2r。
晶胞体内原子分别与上下底形成两个正四面体,由正四面体求高h。
正四面体的高为正四面体边长的
倍(由正方体得出),则h=2×
×2r=
r
晶胞体积V(晶胞)=a2×sin60°×h=4r2×
×
r=8
r3
一个晶胞中原子数为2,原子的总体积V(原子)=2×
=
空间利用率为V(原子)/ V(晶胞)=
/8
r3=0.74=74%
(4)金属晶体的四种堆积模型对比:
堆积模型 |
采用这种堆积的代表 |
空间利用率 |
配位数 |
晶胞 |
简单立方 |
Po |
52℅ |
6 |
|
体心立方 |
Na K Fe |
68℅ |
8 |
|
六方最密堆积 |
Mg Zn Ti |
74℅ |
12 |
|
面心立方最密堆积 |
Cu Ag Au |
74℅ |
12 |
|
思考:
石墨的熔、沸点分别为3652℃~3697℃、4827℃。石墨具有导电性,是一种很好的电极材料。石墨具有润滑性,工业上常用其作固体润滑剂。石墨质软呈灰黑色固体,工业上可作铅笔芯原料。据有关对石墨的描述推测,石墨是否同金刚石一样属于原子晶体?
分析:
原子晶体熔、沸点高,硬度大,一般不导电,如金刚石。而石墨熔、沸点虽高却质软、润滑、能导电。那它属何种晶体呢?其结构如何?
石墨晶体结构。
小结:
(1)石墨晶体是层状结构。每一层内碳原子都采取sp2杂化,排列成正六边形,形成平面六元并环结构,构成平面的网状结构。
(2)同一层内每个碳原子跟其他三个碳原子以较强的共价键相结合(C—C键长为142pm,键角为120°),使石墨熔、沸点很高。如同原子晶体。
(3)层间距离为355pm,说明层间没有化学键相连,层与层之间以较弱的范德华力相结合,使得片层之间易滑动,质软。如同分子晶体。
(4)石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面,由于所有的p轨道相互平行而且相互重叠,使p轨道中的电子可在整个碳原子平面中运功,形成能自由移动的电子。因此,石墨像金属一样有金属键,有导电性。如同金属晶体。由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨的平面方向。
由于在石墨晶体中既有共价键又带有金属键的性质,而层间结合则依靠范德华力。因此像石墨这样的晶体(含两种以上作用力)一般称为过渡型晶体或混合型晶体。
3、石墨
(1)晶体结构:石墨晶体是层状结构,是一种过渡型晶体或混合型晶体。(二维空间的原子晶体)
(2)物理性质:熔、沸点高,硬度小,易导电。
思考:
石墨晶体中每一个正六边形占有的C原子数平均为几个?C—C键数多少个?
石墨晶体中每个碳原子被3个正六边形共用,每个C—C键2个正六边形共用,故每个正六边形平均只占有:
C原子数=6×
=2个;C—C键数=6×
=3个。
典型例题:
1、关于金属Zn,下列说法正确的是( )
A.Zn原子采用非密置层堆积,配位数为6
B.Zn原子采用体心立方堆积,配位数为8
C.Zn原子采用六方紧密堆积,配位数为12
D.Zn原子采用面心立方紧密堆枳,配位数12
答案:C。
2、某金属晶体,经X射线衍射测定,发现其晶胞中每个原子周围有12个原子,此金属不可能是( )
A.Ti B.Fe
C.Mg D.Au
答案:B。
3、关于Au与Fe对比,下列说法正确的是( )
A.Au晶体中原子的配位数高于Fe晶体中原子的配位数,所以Au的熔点高
B.Au原子采用面心立方紧密堆积,Fe原子采用六方紧密堆积,所以Fe的导电性差
C.Au晶体中的电子气在电场中的运动速度更快
D.Au晶体的空间利用率高于Fe晶体,所以Au的硬度大
答案:C。
4、金属晶体堆积模型中,配位数与空间利用率的关系为( )
A.配位数越大,空间利用率越低
B.配位数相同,空间利用率不一定相同
C.堆积方式越紧密,配位数越高,利用率越大
D.配位数最小的堆积模型,利用率小于50%
答案:C。
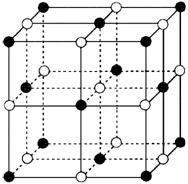
5、某新型合金,经X射线衍射测定后,绘制出的晶胞如下,此合金原子采用的是哪种堆积方式(以同种原子堆积为研究对象)( )
A.简单立方 B.钾型
C.镁型 D.铜型
答案:D。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -