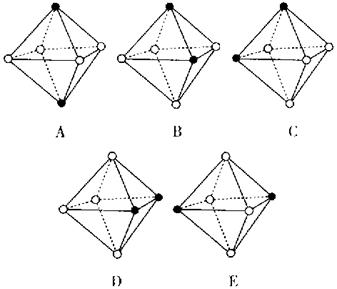
1.金属晶体中的金属原子的堆积基本模式有( )
A.1种 B.2种
C.3种 D.4种
2.金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是( )
A.4 B.3
C.2 D.1
3.仔细观察下图这种堆积方式是( )
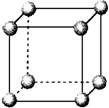
A.钾型 B.简单立方
C.镁型 D.铜型
4.晶体结构属于面心结构的是( )
A.Mg B.C
C.I2 D.Cu
5.下列排列方式是镁型堆积方式的是( )
A.ABCABCABC B.ABABAB
C.ABBAABBA D.ABCCBAABCCBA
6.下列金属晶体采取的堆积方式是铜型的是( )
A.Ag B.Fe
C.Zn D.Po
7.金属晶体的基本堆积方式中空间利用率最高的是( )
A.简单立方 B.钾型
C.镁型 D.铜型
8.下列有关晶体的叙述正确的是( )
A.金属晶体含有金属阳离子和自由电子
B.原子晶体一定是单质
C.分子晶体一定是化合物
D.金属晶体的硬度>原子晶体的硬度>分子晶体的硬度
9.下列说法正确的是( )
A.晶体是具有一定几何外观的,所以汞不属于金属晶体
B.金属一般硬度差别较大,如钠可以用小刀切,但钠属于金属晶体
C.塑料具有一定延展性,所以属于金属晶体
D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体
10.科学家发现的钇钡铜氧化合物在90 K具有超导性,若该化合物晶体的晶胞结构如图所示,则该化合物的化学式可能是( )
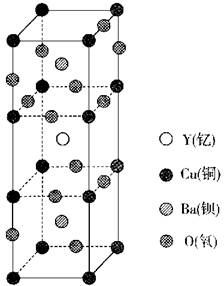
A.YBa2Cu3O4 B.YBa2Cu2O5
C.YBa2Cu3O5 D.YBaCu4O4
11.关于金属晶体的六方最密堆积的结构形式的叙述正确的是( )
A.晶胞是六棱柱 B.晶胞是六面体
C.每个晶胞中含4个原子 D.每个晶胞中含17个原子
13.氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(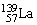 )和镍(
)和镍(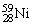 )的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
)的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
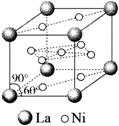
(1)一定条件下,该储氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收3个H2,这一过程用化学方程式表示为____________________。
(2)下列关于该储氢材料及氢气的说法中,正确的是__________(填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料储氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
Ⅰ、镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。
Ⅱ、在Ni2+的溶液中加入强碱时,会生成Ni(OH)2沉淀,在强碱性条件下,该沉淀可以被较强的氧化剂(如NaClO)氧化为黑色的难溶性物质NiO(OH)。
Ⅲ、镍易形成配合物如:Ni(CO)6、[Ni(NH3)6]2+等。
写出将NiO(OH)溶于浓盐酸的化学方程式:____________________。
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成NH3得到新的配合物,则以下物质中互为同分异构体的是__________。(填字母编号,任填一组)(图中黑点为NH3,圆圈为CO,Ni略去)