
 例1、(海南)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是( )
例1、(海南)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是( )
 A.Li,F B.Na,F
A.Li,F B.Na,F
C.Na,C1 D.Mg,O
解析:
比较两原子电负性的差,其中Na与F的电负性差最大。
答案:B
 例2、(上海)在通常条件下,下列各组物质的性质排列正确的是( )
例2、(上海)在通常条件下,下列各组物质的性质排列正确的是( )
 A.熔点:
A.熔点: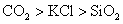
B.水溶性: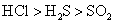
 C.沸点:乙烷>戊烷>丁烷
C.沸点:乙烷>戊烷>丁烷
D.热稳定性: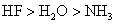
解析:
一般原子晶体熔点很高,离子晶体熔点较高,分子晶体熔点较低,A项错。二氧化硫的溶解度大于硫化氢,B项错。随着碳原子数增多,烷烃的沸点升高,故C项错。非金属元素的得电子能力越强,即非金属性越强,其氢化物越稳定,D项正确。
答案:D
例3、(广东理基)下列说法正确的是( )
A.MgSO4晶体中只存在离子键
B.含Ca2+、Mg2+的水都是硬水
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
解析:
A项中硫酸根离子中含有共价键;B项中正常的水也一样含有钙离子和镁离子,只是硬水中的钙离子和镁离子含量较高; C项中雾属于胶体中的气溶胶,在树林里看到的光束就是丁达尔现象;D项中玻璃是混合物,不是氧化物。
答案:C