| 离子晶体 |
主编:黄冈中学化学集体备课组
思考:
(1)我们已经学习过分子晶体、原子晶体和金属晶体,它们的结构粒子和粒子间的相互作用分别是什么?
|
结构粒子 |
粒子间的相互作用 |
分子晶体 |
分子 |
分子间作用力(范德华力、氢键) |
原子晶体 |
原子 |
共价键 |
金属晶体 |
金属阳离子和自由电子 |
金属键 |
(2)下列物质中哪些是分子晶体?哪些是原子晶体?哪些是金属晶体?
P2O5、 SiC、 Kr、蔗糖、 Ge、Na2O、 Li
NH4Cl、O2、Na2SO4、NaCl、Bi、 CsF
分子晶体:P2O5、Kr、蔗糖、O2
原子晶体:SiC、Ge
金属晶体:Li、Bi
注意:Na2O、NH4Cl、Na2SO4、NaCl、CsF是由阴阳离子构成的离子化合物,它们的晶体是离子晶体。
思考:
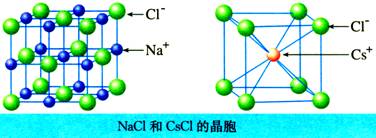
构成NaCl、CsCl晶体的粒子分别是什么?粒子间的相互作用是什么?
构成NaCl晶体的粒子是Na+和Cl-,构成CsCl晶体的粒子是Cs+和Cl-,NaCl、CsCl晶体中粒子间的相互作用均为离子键。
1、定义:由阳离子和阴离子通过离子键结合而成的晶体称为离子晶体。
要从以下几个方面理解离子晶体:
(1)结构粒子:阴、阳离子。
(2)粒子间相互作用:离子键。
(3)种类:强碱、活泼金属氧化物、绝大多数盐。
思考:
请同学们结合氯化钠晶体模型思考以下问题,氯化钠晶体中:
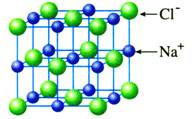
①每个Na+周围最邻近的Cl-有多少个?每个Cl-周围最邻近的Na+有多少个?
每个Na+周围最邻近的Cl-有6个,每个Cl-周围最邻近的Na+有6个。
②一个NaCl晶胞中Na+、Cl-离子数目分别为多少个?Na+和Cl-的数目之比为多少?
氯化钠晶体的一个晶胞中:
Na+数:1+12×
=4;Cl-数:8×
+6×
=4
显然,N(Na+)∶N(Cl-)=1∶1。
③整个晶体中是否存在单个的NaCl分子。
NaCl晶体是由Na+和Cl-构成的离子晶体,整个晶体中不存在单个的NaCl分子,但在气态NaCl中存在NaCl分子(称为离子分子)。
注意:“NaCl”是表示离子晶体中离子个数比的化学式,而不是表示分子组成的分子式。
思考:
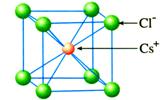
CsCl晶体中:
①每个Cs+周围最邻近的Cl-有_________个?每个Cl-周围最邻近的Cs+有_________个?Cs-和Cl-的数目比为_________。是否存在单个CsCl分子_________。
8;8;1∶1;否
②一个CsCl晶胞中Cs+、Cl-离子数目分别为多少个?并确定晶体化学式。
CsCl晶体的一个晶胞中:
Cl-数:8×1/8=1;Cs+数:1×1=1
所以,氯化铯晶体的化学式为CsCl。
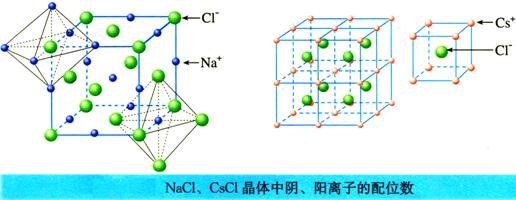
2、离子晶体中离子的配位数(C.N.)
(1)定义:是指离子晶体中一个离子周围最邻近的异电性离子的数目。
思考:
NaCl和CsCl晶体中阴、阳离子的配位数分别为多少?
离子晶体 |
阴离子的配位数 |
阳离子的配位数 |
NaCl |
6 |
6 |
CsCl |
8 |
8 |
表1 几种离子的离子半径
离子 |
Na+ |
Cs+ |
Cl- |
离子半径/pm |
95 |
169 |
181 |
表2 NaCl、CsCl中正、负离子的半径比和配位数。
NaCl |
CsCl |
r+/r- =0.52 |
r+/r- =0.93 |
C.N.=6 |
C.N.=8 |
思考:
你认为是什么因素决定了离子晶体中离子的配位数?
NaCl、CsCl晶体中正、负离子的半径比不同,阴、阳离子的配位数不同,因此,晶体中正、负离子的半径比(r+/r-)决定了离子晶体中离子的配位数。
(2)决定离子晶体中离子的配位数的因素:正、负离子的半径比。
(3)决定离子晶体结构的因素:
①正、负离子的半径比(r+/r-)——几何因素。
思考:
NaCl正负离子的配位数均为6,CsCl正负离子的配位数均为8,为什么NaCl、CsCl中正负离子的配位数相同?
NaCl和CsCl正负离子电荷绝对值相同,正负离子个数相同,导致正负离子配位数相同。
思考:
如果正负离子电荷绝对值不同,正负离子个数不同,正负离子配位数是否相同呢?
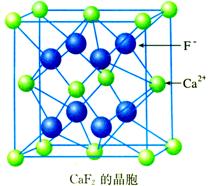
CaF2晶体中Ca2+的配位数为8,F-的配位数为4,是由于CaF2晶体中Ca2+和F-的电荷比是2∶1,不相同,Ca2+和F-的个数比是1∶2,不相同,导致Ca2+和F-的配位数也不相同,其比为2∶1。
②正、负离子的电荷比——电荷因素。
③离子键的纯粹程度——键性因素。
思考:
在离子晶体中,离子间存在着较强的离子键,那么表现在性质上会有何特点呢?请同学们借此并联系实际对离子晶体的熔沸点、硬度、挥发性、机械加工等一般性质进行推测。
离子晶体中由于离子间有较强的离子键,使离子晶体的硬度较大,难于压缩、不宜进行机械加工,无挥发性;而且,要使离子晶体由固态变成液态或气态,需要较多的能量破坏较强的离子键,因此,离子晶体具有较高的熔、沸点。
|
NaCl |
CsCl |
熔点 |
801℃ |
645℃ |
沸点 |
1413℃ |
1290℃ |
3、离子晶体的物理性质特点:
硬度较大、难于压缩,难于挥发,有较高的熔、沸点。
思考:
同为离子晶体,NaCl却比CsCl的熔、沸点高,为什么?
离子键是存在于阴阳离子之间的一种静电作用。其强弱与阴阳离子的半径和离子电荷数有关。一般来说,离子半径越小,离子电荷数越高,离子键就越强,晶体熔沸点就越高。从库仑定律可直接看出这一关系(F=k
)。
对于NaCl和CsCl,由于阴、阳离子所带电荷数相同,而r(Na+)<r(Cs-),所以F(NaCl)>F(CsCl),故熔、沸点为:NaCl>CsCl。
4、影响离子晶体熔沸点的因素:
离子半径越小,离子电荷数越高,离子键就越强,晶体熔沸点就越高。
思考:
我们知道带电粒子的定向移动可形成电流,那么由带电离子构成的离子晶体在外加电场作用下能否导电呢?以NaCl晶体为例说明。
干燥NaCl晶体不导电,熔融NaCl或NaCl溶液可以导电。
NaCl晶体中虽有带电的Na+、Cl-存在,但由于较强的离子键将阴阳离子紧密结合而不能自由移动,故固态不能导电,而当晶体受热熔化时,由于温度升高,离子运动加快,克服了阴、阳离子间的作用力,产生了自由移动的离子,所以,熔融NaCl能导电。当NaCl晶体溶于水时,受水分子的影响,离子间作用力减弱,电离成能自由移动的水合离子,所以,NaCl水溶液也能导电。
总结:离子晶体导电的条件及过程:
5、四种类型晶体的比较
晶体类型 |
离子晶体 |
分子晶体 |
原子晶体 |
金属晶体 |
构成粒子 |
阴、阳离子 |
分子 |
原子 |
金属阳离子和自由电子 |
粒子间相互作用 |
离子键 |
分子间作用力 |
共价键 |
金属键 |
熔沸点 |
较高 |
较低 |
很高 |
有高(W)、有低(Hg) |
硬度 |
硬而脆 |
小 |
很大 |
有大(Cr)、有小(Na) |
导电性 |
固体不导电,熔化或溶于水导电 |
一般不导电,有的溶于水导电 |
一般不导电(晶体Si为半导体) |
良导体 |
溶解性 |
差别较大,易溶于极性溶剂 |
相似相溶 |
难溶于一般溶剂 |
一般不溶,活泼金属与水反应 |
熔化、汽化及溶解时对化学键的影响 |
离子键遭破坏 |
熔化、汽化时分子间作用力遭破坏,电离或与水反应时分子内共价键遭破坏 |
共价键遭破坏 |
金属键遭破坏 |
典型实例 |
NaCl、CsCl |
冰、干冰 |
金刚石、晶体Si |
金属 |
典型例题:
1、下列各类化合物中,固态时只能形成离子晶体的是( )
A.非金属氧化物 B.非金属单质
C.强酸 D.强碱
答案:D。
2、含有共价键的离子晶体是( )
A.MgCl2 B.NaOH
C.H2S D.(NH4)2S
答案:BD。
3、离子晶体不可能具有的性质是( )
A.较高的熔、沸点 B.良好的导电性
C.溶于极性溶剂 D.坚硬而易粉碎
答案:B。
4、关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.离子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
答案:A。
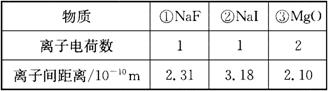
5、NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
答案:B。
6、同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:
A组物质 |
NaCl |
KCl |
CsCl |
熔点(K) |
1074 |
1049 |
918 |
B组物质 |
Na |
Mg |
Al |
熔点(K) |
317 |
923 |
933 |
A组____________________________________________________________;
B组____________________________________________________________。
答案:
A组:一般来说,阴阳离子的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔沸点越高,故熔点:NaCl>KCl>CsCl。
B组:一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,晶体的熔沸点越高。故熔点:Al>Mg>Na。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -