| 构造原理、能量最低原理和光谱 |
主编:黄冈中学化学集体备课组
一、构造原理与电子排布式
思考:如果原子的核外电子完全按能层次序排布,钾原子的电子排布应是2、8、9,但实际上式2、8、8、1,为什么?
1、构造原理
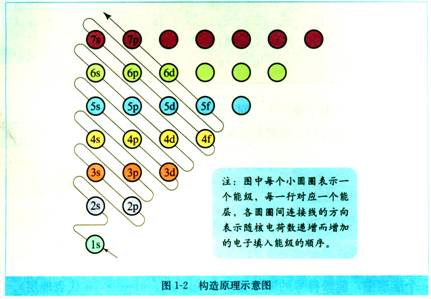
(1)构造原理:原子中能级的能量由低到高的顺序,即电子填充的能级顺序。
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s……
(2)能级交错现象:能层序数大的能级反而比能层小的能级能量低。
如E(4s)<E(3d)、E(5s)<E(4d)、E(6s)<E(5d)、E(6s)<E(4f) 、E(5p)<E(4f)等。
由构造原理可总结能级交错规律:Ens<E(n-2)f(n≥6)<E(n-1)d(n≥4)<Enp(n≥2)
由能级交错规律可总结电子填入能级的顺序:
ns(n≥1)→(n-2)f(n≥6)→(n-1)d(n≥4)→np(n≥2)
思考:构造原理中能级顺序的实质是各能级的能量高低顺序。构造原理中能级顺序是如何得出的呢?
①不同能层的能量高低顺序:K<L<M<N<O<P<Q。
②相同能层的不同能级的能量高低顺序:ns<np<nd<nf。
③英文字母相同的不同能级的能量高低顺序:1s<2s<3s<4s;2p<3p<4p;3d<4d<5d。
④不同能层不同能级可由下面的公式得出(能级交错规律):ns < (n-2)f < (n-1)d < np (n为能层序数)。
结合上面四点,可得出构造原理中能级顺序:
ns(n≥1)→(n-2)f(n≥6)→(n-1)d(n≥4)→np(n≥2)。
2、电子排布式
(1)电子排布式的书写
如:Na : 1s22s22p63s1
S:1s22s22p63s23p4
K : 1s22s22p63s23p64s1
注:电子排布式中能级符号右上角的数字是该能级上排布的电子数。
练习:写出C、N、O、Ne、Mg、Si、P、Cl、Ca、Sc的电子排布式。
注:书写电子排布式时,能层低的能级要写在左边,要按能层顺序书写,不能按填充顺序写。如Sc的电子排布式中最后两个能级表示为3d14s2,不能写成4s23d1。
思考:钠的电子排布可写成[Ne]3s1,方括号里的符号是什么意义?
(2)电子排布式的简写:[前一个周期稀有气体元素符号]+外围电子(最外层电子、价电子)
练习:写出8号、14号、26号元素简化的电子排布式?
答案:
O:[He]2s22p4;Si:[Ne] 3s23p2;Fe:[Ar] 3d64s2。
(3)原子的特征电子构型(即外围电子层排布):表示原子电子层结构特征的式子。如: Sc:3d14s2;O:2s22p4;Si:3s23p2;Fe:3d64s2。
练习:写出Br、Kr的电子排布式。
35Br:1s22s22p63s23p63d104s24p5
36Kr:1s22s22p63s23p63d104s24p6
思考:为什么原子最外层最多只能容纳8个电子?次外层最多能容纳18个电子?倒数第三层最多能容纳32个电子?
1、依据:构造原理中的电子排布顺序,其实质是各能级的能量高低顺序,可由公式得出:ns < (n-2)f < (n-1)d < np。
2、解释:(1)最外层由nsnp组成,电子数不大于2+6=8。
(2)次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
(3)倒数第三层由(n-2)s(n-2)p(n-2)d(n-2)f组成,电子数不大于2+6+10+14=32。
二、能量最低原理、基态与激发态和光谱
1、能量最低原理:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。即电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。
2、基态与激发态
基态原子:处于最低能量的原子。
激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
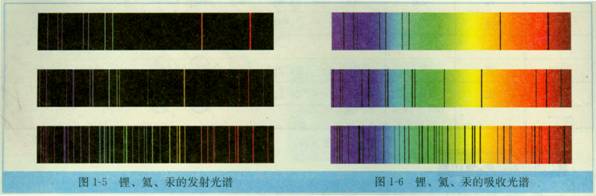
3、原子光谱:不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
(1)原子光谱的分类:
发射光谱:原子从激发态到低激发态或基态释放能量,物体发光产生的光谱。
吸收光谱:原子从基态到激发态或低激发态到高激发态吸收能量(吸收光能)产生的光谱。
(2)原子光谱的特征:
发射光谱:暗背景,亮线,线状不连续;
吸收光谱:亮背景,暗线,线状不连续。
知识拓展:
氢原子处在正常状态时电子是在离核最近的n=1的可能轨道上运动,这时它的能量最少也比较稳定。当原子受到外界因素的激发时电子吸收一定的能量而跃入其他能量较高的能级上去,这时电子不稳定.它能自发地跳跃到能量较低能级上并发出光子,大量处于激发态的原子会发出各不相同的谱线组成了氢原子光谱的全部谱线。
(3)原子光谱的应用:
①发现新元素。如Cs、Rb、He的发现。
②光谱分析:利用原子光谱线上的特征谱线来鉴定元素。
随堂练习:
1、下列能级的能量大小比较,正确的是( )
A.E(4s)>E(3d) B.E(6p)>E(5f)
C.E(6s)<E(5p) D.E(4d)<E(5p)
答案:D
2、下列各原子或离子的电子排布式错误的是( )
A.Al:1s22s22p63s23p1 B.O2-:1s22s22p6
C.Na+:1s22s22p6 D.Si:1s22s22p2
答案:D
3、某元素的最常见的化合价为-2价,则该元素的原子最外电子层排列式是( )
A.ns2 B.ns2np2
C.ns2np4 D.ns2np6
答案:C
4、下列各组指定的元素,不能形成XY2型化合物的是( )
A.2s22p2和2s22p4 B.3s23p4和2s22p4
C.3s2和2s22p5 D.3s1和3s23p4
答案:D
5、X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3
C.X2YZ2 D.XYZ3
答案:A
6、同一原子的基态和激发态相比较( )
A.基态时的能量比激发态时高
B.基态时比较稳定
C.基态时的能量比激发态时低
D.激发态时比较稳定
答案:BC
7、生活中的下列现象与原子核外电子发生跃迁有关的是( )
A.钢铁长期使用后生锈
B.节日里燃放的焰火
C.金属导线可以导电
D.夜空中的激光
答案:BD
8、当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,下列说法正确的是( )
A.碳原子由基态变为激发态
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量
答案:AC
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -