1.下列表达方式错误的是( )
A.甲烷的电子式: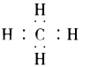
B.氟化钠的电子式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:
2.下列各原子或离子的电子排布式错误的是( )
A.Na+:1s22s22p6 B.F:1s22s22p5
C.Cl-:1s22s22p63s23p5 D.Ar:1s22s22p63s23p6
3.表示一个原子在第三个电子层上有10个电子可以写成( )
A.3s10 B.3d10
C.3s23p63d2 D.3s23p53d3
4.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nL)表示某能级的能量,以下各式中正确的是( )
A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)> E(4s)> E(3p)> E(3s)
C.E(5s)> E(4f)> E(4p)> E(3d) D.E (5s)> E(4s)> E(4f)> E(3d)
5.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A.+1 B.+2
C.+3 D.-1
6.A原子的结构示意图为 。则X、Y及该原子3p能级上的电子数可能分别为( )
。则X、Y及该原子3p能级上的电子数可能分别为( )
A.18、6、4 B.20、8、6
C.18、8、6 D.15~20、3~8、1~6
7.Pb2+的价电子结构是( )
A.5s2 B.6s26p2
C.5s25p2 D.5s25p65d106s2
8.某原子的一种激发态为1s22s12p1,则该元素在周期表中的位置为( )
A.第二周期,ⅠA族 B.第二周期,ⅡA族
C.第一周期,ⅠA族 D.第一周期,ⅡA族
9.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流作用下,氖原子与构成灯管的物质反应
10.当氮原子的核外电子排布由1s22s22p3转变为1s22s12p4时,下列说法正确的是( )
A.氮原子由基态变为激发态
B.氮原子由激发态变为基态
C.氮原子要从外界环境中吸收能量
D.氮原子要向外界环境释放能量
11.如果用E代表能量,请根据要求回答下列问题:
(1)分别将下列能级按能量由低到高的顺序排列:
①E(3s)、E(2s)、E(4s)、E(1s):______________________。
②E(3s)、E(3d)、E(3p)、E(4s):______________________。
(2)原子中的电子分布在不同的能级中,有人说:“当能级不同时,p能级的能量大于s能级,d能级的能量大于p能级,f能级的能量大于d能级。”这种说法对吗?请说明理由:
_________________________________________________________________________。
显示答案
|
11.(1)①E(1s)<E(2s)<E(3s)<E(4s)
②E(3s)<E(3p)<E(4s)<E(3d)
(2)不对。核外电子的能量由能层和能级两个方面决定。同一能层的电子,当能级不同时,有E(ns)<E(np)<E(nd)<E(nf);当能层不同时,不一定正确,如E(4s)>E(3p) |
12.写出下列原子的电子排布式。
(1)16S (2)29Cu (3)24Cr (4)34Se (5)30Zn (6)26Fe
(1) ________________________________ (2) __________________________________
(3) ________________________________ (4) __________________________________
(5) _________________________________ (6) __________________________________
显示答案
13.A、B两元素在周期表中位于同一周期,核电荷数均小于36,最外层均为一个电子,A的次外层为8个电子,B的电子排布式为1s22s22p63s23p63d104s1(或[Ar]3d104s1),则A的元素符号为__________,位于周期表第__________周期,__________族,电子排布式为__________;B的元素符号为__________,位于周期表第__________周期,__________族。
显示答案
|
13.K;4;ⅠA; 1s22s22p63s23p64s1; Cu;4;ⅠB |
14.按所示格式填写下表:
原子序数 |
电子排布式 |
价层电子排布 |
周期 |
族 |
49 |
________________________ |
________ |
________ |
________ |
________ |
1s22s22p6 |
________ |
________ |
________ |
________ |
________________________ |
3d54s1 |
________ |
________ |
________ |
________________________ |
________ |
6 |
ⅡB |
显示答案
|
14.1s22s22p63s23p63d104s24p64d105s25p1;5s25p1; 5 ;ⅢA ;
10; 2s22p6;2;0;
24; 1s22s22p63s23p63d54s1;4;ⅥB;
80; 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2;5d106s2 |
15.有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物的水溶液显碱性,而其最高价氧化物水化物为强酸。E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个。
(1)写出元素名称:
A________,B________,C________,D________,E。
(2)各粒子电子排布式:________________________。
(3)写出C1、C2、C3粒子的符号:______________________________。
(4)写出E原子的结构示意图:__________,E的氢化物的分子式__________。
(5)写出A的单质、B的单质分别与水反应的化学方程式:________________________,将反应后生成的溶液混合,发生反应的离子方程式为____________________。
显示答案