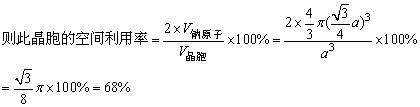| 晶格能 |
主编:黄冈中学化学集体备课组
一、晶格能
1、定义:气态离子形成1mol离子晶体时释放的能量。
某些离子晶体的晶格能/(kJ·mol-1)
F-
Cl-
Br-
I-
Li+
1036
853
807
757
Na+
923
786
747
704
K+
821
715
682
649
Cs+
785
689
660
630
Rb+
740
659
631
604
思考:
离子带电荷数相同时,离子半径大小与晶格能有何关系?
离子带电荷数相同时,离子半径越小的离子晶体的晶格能越大。
某些离子晶体的晶格能/(kJ·mol-1)
AB型离子晶体
离子电荷
晶格能(KJ/mol)
熔点/℃
摩氏硬度
NaF
1
923
993
3.2
NaCl
1
786
801
2.5
NaBr
1
747
747
<2.5
NaI
1
704
661
<2.5
MgO
2
3791
2852
6.5
CaO
2
3401
2614
4.5
SrO
2
3223
2430
3.5
BaO
2
3054
1918
3.3
思考:
离子带电荷数与晶格能有何关系?
离子电荷越大的离子晶体的晶格能越大。
思考:
晶格能的大小与离子晶体的熔点、硬度有何关系?
晶格能越大,形成的离子晶体熔点越高,硬度越大。
2、规律:(1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。
(2)晶格能越大,形成的离子晶体熔点越高,硬度越大,晶体越稳定。
3、岩浆晶出规则与晶格能
(1)岩浆晶出:火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,简称“岩浆析出”。实验证明,岩浆晶出的次序与晶格能的大小有关。
硫化物矿物的晶出次序与晶格能
硫化物矿物
晶格能(KJ/mol)
晶出次序
MoS2
FeS2
ZnS
PbS
HgS
2345.2
1157.2
771.41
670.0
689.6
思考:
矿物的晶格能大小与晶出次序有何关系?
晶格能越大的矿物越先晶出。
硅酸盐和石英的晶出次序与晶格能
硅酸盐矿物和石英
晶格能(KJ/mol)
晶出次序
橄榄石
辉石
角闪石
云母
长石
石英
4.4×103
4.1×103
3.8×103
3.8×103
2.4×103
2.6×103
思考:
石英总是在各种硅酸盐析出后才晶出,为什么?
其主要原因是它的晶格能较小,此外,也与它不容易在岩浆中达到饱和有关,只有当各种金属离子以硅酸盐形式析出后,石英的浓度才达到饱和。
(2)岩浆晶出规则:矿物从岩浆中先后结晶的规律称为岩浆晶出规则。
晶体从岩浆析晶难易不仅跟岩浆的组成有关,也与析出晶体的晶格能有关:晶格能高的晶体,熔点较高,更容易在岩浆冷却过程中先结晶析出。
二、有关晶体的计算
1、计算晶胞的结构粒子数及晶体的化学式
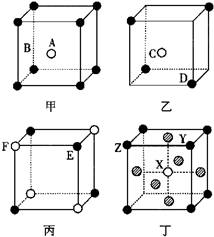
例1、现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为;丁晶体的化学式为。
答案:
1:1;C2D;EF ;XY3Z。
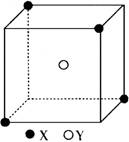
例2 、某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析:
(1)在一个晶胞中有个X,1个Y,所以该晶体的化学式为。
(2)晶体中距离最近的2个X与一个Y所形成的夹角∠XYX角度为(填角的度数)。
答案:
(1)1/2; 1; XY2
(2)109.5°
2、有关晶胞密度、相对分子质量等的计算
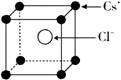
例3、已知CsCl晶体的密度为ρ g/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
分析:
依图知,1个CsCl晶胞中含1个Cs+和1个Cl-,即1molCsCl晶胞含1molCsCl;
依题意,晶胞边长为a cm,则1mol晶胞的体积为NAa3 cm3,质量为NAa3ρ g,可知:
M(CsCl)×1mol =NAa3ρ g;M(CsCl)=NAa3ρ g /mol 。
答案:A
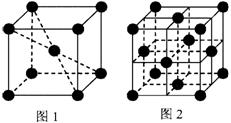
例4 、1183K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
(1)铁原子的简化电子排布式为__________;铁晶体中铁原子以__________键相互结合。
(2)在1183K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为__________个;在1183K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为__________个。
(3)纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为__________(1183K以下与1183K以上之比)。
分析:
设Fe原子半径为r,图1晶胞边长为a,图2晶胞边长为b。
图1中,体对角线上Fe原子相切,有,
a=4r, a=
r;
图2中,面对角线上Fe原子相切,有,
b=4r, b=
r
则,
。
(4)转变温度前后两者的密度比为_______(1183K以下与1183K以上之比)。
图1和图2一个晶胞分别含有2个、4个Fe原子,则图1和图2晶体的密度分别为:
ρ1=
ρ2=
则,
。
答案:(1)[Ar]3d64s2 金属
(2)8 12
(3)
(4)
3、有关晶胞的空间利用率的计算
例5、金属的性质与其结构有密切的关系,金属晶体由于某些结构上的相似点导致了金属具有一些共同的性质;同样由于结构上的不同点,导致了每种金属都具有各自的特性:
(1)请指出金属具有延展性的原理是___________________________。
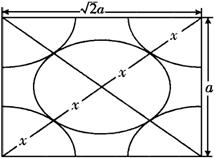
(2)金属的紧密堆积有不同的形式,请画出金属钠的晶胞,并指出一个晶胞含有_____个钠原子。
(3)计算该晶胞的空间利用率。
解:
(1)金属晶体中自由电子与金属阳离子形成金属键,当金属阳离子层与层之间发生相对移动时,自由电子可与金属阳离子迅速形成新的金属键,所以金属具有延展性
(2)见下图
一个晶胞含有2个钠原子。
(3)设该晶胞的边长为a cm,则该晶胞的体积V晶胞=a3 cm3。
由于此晶胞是紧密堆积则可以画出:
由于此晶胞中有两个钠原子,而一个钠原子的体积为
典型例题:
1、下列含有极性键的离子晶体是( )
①醋酸钠 ②氢氧化钾 ③金刚石 ④乙醇 ⑤氯化钙
A.①②⑤ B.①②
C.①④⑤ D.①⑤
答案:B。
2、下列说法正确的是( )
A.一种金属元素和一种非金属元素一定能形成离子化合物
B.离子键只存在于离子化合物中
C.共价键只存在于共价化合物中
D.离子化合物中必定含有金属元素
答案:B。
3、下列大小关系正确的是( )
A.晶格能:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
答案:B。
4、已知:三种氟化物的晶格能如下表:
晶格能(KJ/mol)
Na+
923
Mg2+
2957
Al3+
5492
三种氟化物的晶格能的递变原因是____________________________________。
答案:
离子电荷越大,离子半径越小,离子晶体的晶格能越大,
离子半径:Na+> Mg2+>Al3+,离子电荷:Na+< Mg2+<Al3+
5、已知:硅酸盐和石英的晶格能如下表:
硅酸盐矿物和石英
晶格能(kJ/mol)
橄榄石
4400
辉石
4100
角闪石
3800
云母
3800
长石
2400
石英
2600
回答下列问题:
(1)橄榄石和云母晶出的顺序是________________________。
(2)石英总是在各种硅酸盐析出后才晶出的原因是________________________。
(3)推测云母和橄榄石的熔点顺序为____________,硬度大小为____________。
6、下表列出了钠的卤化物和硅的卤化物的熔点:
NaX
NaF
NaCl
NaBr
NaI
熔点
995
801
775
651
SiX4
SiF4
SiCl4
SiBr4
SiI4
熔点
—90.2
—70.4
5.2
120.5
回答下列问题:
(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是____________________________________________________________。
(2)NaF 的熔点比NaBr的熔点高的原因是________________________。SiF4的熔点比SiBr4的熔点低的原因是____________________________________。
(3)NaF和NaBr的晶格能的高低顺序为____________,硬度大小为____________。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -