|
一、选择题
1.下列关于晶格能与键能的说法不正确的是( )
A.键能越大,晶格能也就越大
B.键能与晶格能大小关系一致
C.键能和晶格能均能反映出离子键的强弱
D.离子半径越小,离子所带电荷越少,键能越大
2.下列物质中晶格能大小比较正确的是( )
A.BaO>CaO>MgO B.NaF>NaCl>NaBr
C.NaI>MgO>BaO D.PbS>ZnS>MgO
3.离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电引力,静电引力大则熔点高,引力小则反之。则KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>NaCl>KCl D.CaO>BaO>KCl>NaCl
4.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验一定能说明CaF2是离子晶体的是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
5.关于离子晶体的导电性下列说法不正确的是( )
A.离子晶体导电的前提是先电离出自由移动的阴阳离子
B.离子晶体在熔融状态下一定能够导电
C.所有的离子晶体受热均能导电
D.难溶于水的强电解质如BaSO4、CaCO3等溶于水,由于浓度极小,故导电性极差。通常情况下,我们说它们的水溶液不导电
6.下列按晶格能由大到小排列的是( )
A.NaF>NaCl>NaBr>NaI
B.Na2S>Na2O>NaCl>NaI
C.NaCl>CaCl2>MgCl2>AlCl3
D.MgCO3>CaCO3>SrCO3>BaCO3
7.硫酸盐大多数比较稳定,但是在一定条件下受热也会分解,以下硫酸盐热稳定性最好的是( )
A.Na2SO4 B.CaSO4
C.BaSO4 D.FeSO4
8.下表是几种碳酸盐的分解温度和阳离子半径
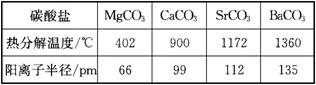
分析上表可以得出( )
A.离子晶体中阳离子的半径越大,越易分解
B.离子晶体中阳离子的半径越小,越易分解
C.离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易
D.离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易
9.下列有关晶格能的说法错误的是( )
A.离子晶体所带电荷越多,晶格能越大
B.离子半径越小,晶格能越小
C.晶格能越大,离子晶体的能量越低
D.晶格能越大,离子晶体的熔点越高
10.下列关于岩浆晶出的说法不正确的是( )
A.晶格能越大的矿物越容易先晶出
B.晶格能越小的矿物越容易先晶出
C.石英总是在各种硅酸盐析出后才晶出与其晶格能较小、不容易在岩浆中达到饱和浓度有关
D.晶格能高的晶体熔点高,更容易在岩浆冷却过程中先结晶析出
二、填空题
11.晶格能越大,形成的离子晶体__________,而且熔点__________,硬度__________。典型的离子晶体,晶格能的大小与离子所带的电荷和离子半径的关系一般是:离子电荷越多,晶格能__________,离子半径越大,晶格能__________。
显示答案
12.已知有关物质的熔、沸点如下:
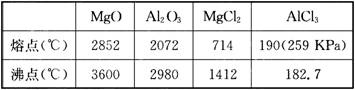
请参考上述数据回答:
(1)工业上常用电解熔融MgCl2的方法生产镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?
______________________________________________________________________。
(2)设计可靠实验证明:MgCl2、AlCl3所属的晶体类型,其实验方法是____________________。
显示答案
|
12.(1)因MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,浪费能源。从表中数据可知,AlCl3易升华,熔、沸点低,应属分子晶体,熔融时无离子产生,不导电,不能被电解
(2)将两种晶体加热加压到熔融状态,测定其导电性,实验表明MgCl2能导电,AlCl3不能导电,由此可确定MgCl2为离子晶体,AlCl3为分子晶体 |
13.下表列出了钠的卤化物和硅的卤化物的熔点:
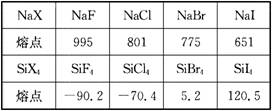
回答下列问题:
(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是____________________。
(2)NaF的熔点比NaBr的熔点高的原因是____________________________。SiF4的熔点比SiBr4的熔点低的原因是______________________________。
(3)NaF和NaBr的晶格能的高低顺序为________________,硬度大小为__________。
显示答案
|
13.(1)钠的卤化物是离子晶体,硅的卤化物是分子晶体,而离子键一般比分子间作用力强得多
(2)F-半径比Br-小,NaF离子键键能比NaBr大 SiF4的相对分子质量比SiBr4小,SiF4的分子间作用力比SiBr4小
(3)NaF>NaBr;NaF>NaBr |
14.(1)已知NiO晶体与NaCl晶体类型、结构相同。回答下列各小题:
①从NiO晶体中可截取出如图所示的立方体。已知该立方体的8个顶点分别为Ni2+和O2-占据。其中有1个Ni2+已经涂黑,请将该立方体中表示其余Ni2+所在位置的小球用笔涂黑。
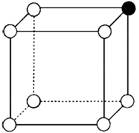
②NiO晶体中距离每个Ni2+距离最近的O2-有__________个,距离最近的Ni2+有__________个。
(2)下列数据是对应物质的熔点(℃)
NaCl |
Na2O |
AlF3 |
AlCl3 |
801 |
920 |
1291 |
190 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
-109 |
2073 |
-57 |
1723 |
据此作出的下列判断中,错误的是__________。
A.铝的化合物晶体中有离子晶体
B.只有BCl3、干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成不同类型的晶体
(3)SiO2晶体结构片断如图所示。SiO2晶体中Si和Si—O键的比例为__________。
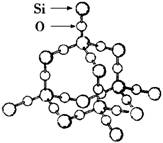
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。

Si(s)+O2(g) SiO2(s),该反应的反应热△H=__________kJ/mol。 SiO2(s),该反应的反应热△H=__________kJ/mol。
显示答案
|
14.(1)①如下图
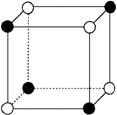
②6; 12
(2)B
(3)1∶4 ;-990 |
15.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有____________________。
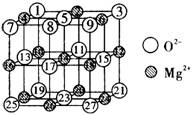
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:__________。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:________________________________________。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
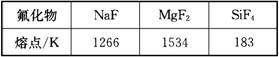
解释表中氟化物熔点差异的原因:________________________________________。
显示答案
|
15.(1)增大离子浓度,从而增大熔融盐的导电性
(2)⑧应为阴影
(3)原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从能量较低的轨道跃迁到能量较高的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来的低能量轨道,并向外界释放能量(光能)
(4)NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,Mg2+比Na+所带电荷多,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点大于NaF |
|