| 电子云与原子轨道、泡利原理和洪特规则 |
主编:黄冈中学化学集体备课组
一、电子云和原子轨道
1、电子运动的特点:
①质量极小,带负电荷;
②运动空间极小(直径约为10-10m);
③高速运动,接近光速(3×1010m/s)。
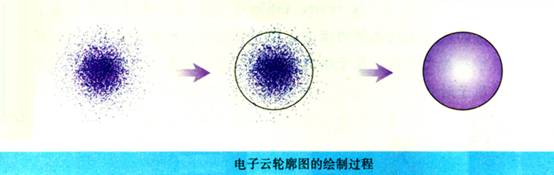
2、电子云:表示电子在一定时间内在核外空间各处出现机会的模型。
(1)氢原子1s电子云:
①形状:呈球形对称。
②分布:离核近处,密度大;离核远处,密度小。
③实质:电子在离核越近处,单位体积空间内电子出现机会多;
电子在离核越远处,单位体积空间内电子出现机会少。
(2)电子云轮廓图:表示电子云轮廓形状的图形。
(3)电子云的形状
①s电子云:以原子核为中心的球形。
大小:1s<2s<3s<4s
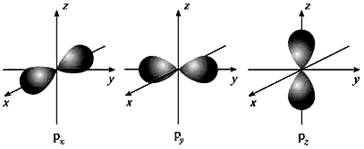
②p电子云:哑铃形。
有3 个相互垂直的伸展方向(取向):Px、Py、Pz。
③d电子云:花瓣形,有5个伸展方向。
f电子云:复杂,有7个伸展方向。
3、原子轨道:电子在原子核外的一个空间运动状态称为一个原子轨道。或在一定的能层上,具有一定的形状和伸展方向的电子云所占据的空间称为一个原子轨道。
(1)决定一个原子轨道的因素:能层,能级(电子云的形状)和伸展方向。
能 级:s p d f
轨道数:1 3 5 7
(2)原子轨道的表示方法:如2Px、2Py、2Pz。
2Px的含义:2—第2能层 P—P能级 x—x轴伸展方向
(3)各能层最多的原子轨道数:
4、电子的自旋:顺时针和逆时针两种状态。常用上下箭头(↑、↓)表示自旋状态相反的电子。
总结:(1)核外电子的运动状态由能层、能级、电子云的伸展方向和电子自旋状态四个方面来决定。
(2)能层、能级、电子云的伸展方向确定电子的原子轨道。
(3)决定电子的运动状态:原子轨道(空间位置)和电子自旋。
(4)能层、能级、原子轨道实质上是电子云的大小、形状、空间伸展方向。
二、泡利原理和洪特规则
1、泡利原理:在一个原子轨道里最多只能容纳2个电子,而且自旋方向相反,这个原理称为泡利原理。
2、电子排布图(轨道表示式)
如:Li
1s22s1 B
1s22s22p1
3、洪特规则:当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则是洪特规则。
如:C
1s22s22p2
练习:写出N、O、F、Na、Mg、Al、Si、P的电子排布式和电子排布图。
N 1s22s22p3
O 1s22s22p4
F 1s22s22p5
Na 1s22s22p63s1
Mg 1s22s22p63s2
Al 1s22s22p63s23p1
Si 1s22s22p63s23p2
练习:写出24号Cr、29号Cu的电子排布式。
Cr:1s22s22p63s23p63d44s2
Cu : 1s22s22p63s23p63d94s2
实际上Cr特征电子构型为d54s1,Cu特征电子构型为d104s1。
4、洪特规则的特例:对于同一个能级,当电子排布为全充满、半充满或全空时,是比较稳定的。
全充满 p6 d10 f14
半充满 p3 d5 f7
全 空 p0 d0 f0
思考:(1)在短周期元素中,原子中单电子有2个的元素有哪些?原子中单电子有3个的元素有哪些?
2个:C、O、Si、S
3个:N、P
(2)在第4周期元素中,原子最外层只有1个电子的元素有哪些?原子最外层有2个电子的元素有哪些?
1个:K、Cr、Cu
2个:Ca、Sc、Ti、V、Mn、Fe、Co、Ni、Zn
随堂练习:
1、下列有关电子云及示意图的说法正确的是( )
A.电子云是笼罩在原子核外的云雾
B.小黑点多的区域表示电子多
C.小黑点疏的区域表示电子出现的机会少
D.电子云是用高速照相机拍摄的照片
答案:C
2、已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是( )
答案:D
3、有主族元素X、Y、Z,其原子序数依次减小,且均不超过20。X原子的最高能层的电子排布为ns1;Y原子的M能层有2个未成对电子;Z原子的最高能层的p轨道上只有一对成对电子。由这三种元素组成的化合物的化学式不可能是( )
A.K2SO3 B.K3PO4
C.K2SiO3 D.Na2SO4
答案:BD
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -