例1、(安徽)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )
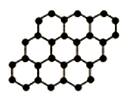
 A.石墨烯与石墨互为同位素
A.石墨烯与石墨互为同位素
 B.0.12g石墨烯中含有6.02×1022个碳原子
B.0.12g石墨烯中含有6.02×1022个碳原子
 C.石墨烯是一种有机物
C.石墨烯是一种有机物
 D.石墨烯中的碳原子间以共价键结合
D.石墨烯中的碳原子间以共价键结合
解析:
A项:因题目中说明“石墨烯可由石墨剥离而成”,故不符合同位素的概念,故A错。
B项:0.12g石墨含碳原子数为0.12g/12g·mol-1×6.02×1023mol-1=6.02×1021,故B错。
C项:石墨烯是无机物,故C错。
D项:一般非金属与非金属元素的原子之间以共价键结合,故D正确。
 答案:D
答案:D
例2、(山东)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 _______ 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 _______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 _______ ,微粒间存在的作用力是 _______ 。
(3)氧化物MO的电子总数与SiC的相等,则M为 _______ (填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 _______ 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键 _______ 。
解析:
(1)Si是14号元素,其电子排布式为:1s22s22p63s23p2;从电负性的角度分析,O和C位于同一周期,非金属性O强于C;C和Si为与同一主族,C的非金属性强于Si,故由强到弱为O>C>Si;(2)SiC中Si和C原子均形成四个单键,故其为sp3杂化;微粒间全部是共价键;(3)MO和SiO2的电子总数相等,故含有的电子数为20,则M含有12个电子,即Mg;MgO和CaO中Mg2+的半径小于Ca2+,使得MgO晶体中的晶格能大于CaO;(4)CO2晶体是分子晶体,其中C的原子半径较小,C、O原子能充分接近,p—p轨道肩并肩重叠程度较大,形成稳定的π键;而Si原子半径较大,Si、O原子间距离较大,p—p轨道肩并肩重叠程度较小,不能形成上述稳定的π键。
答案:
(1)1s22s2sp63s23p2; O>C>Si
(2)sp3; 共价键
(3)Mg;Mg2+半径比Ca2+小,MgO的晶格能大
(4)C的原子半径较小,C、O原子能充分接近,p—p轨道肩并肩重叠程度较大,形成较稳定的π键。而Si原子半径较大,Si、O原子间距离较大,p—p轨道肩并肩重叠程度较小,不能形成稳定的π键。