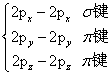| 共价键 |
主编:黄冈中学化学集体备课组
复习提问:
(1)什么叫化学键?化学键包括哪几种?
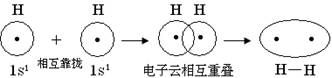
(2)用电子式表示NaCl、HCl、H2、Cl2的形成过程。
(3)什么叫共价键?共价键的本质是什么?
(4)按共价键的共用电子对理论,能否形成H3、H2Cl和Cl3分子?为什么?
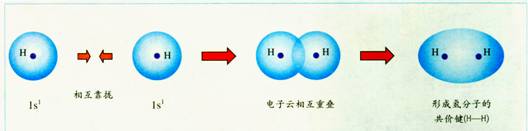
前面已学过电子云,可用电子云的概念来进一步理解共价键:
例如:用电子云描述氢原子形成氢分子的过程。
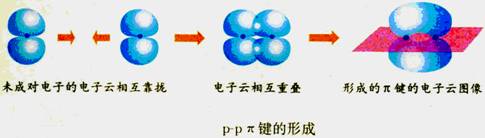
原子间通过共用电子对形成共价键时发生了电子云相互重叠。
1、共价键的本质:在原子之间形成共用电子对或电子云相互重叠。
2、共价键的类型:
(1)σ键
①概念:两个原子的成键轨道沿键轴的方向以“头碰头”的方式重叠。
②特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,即轴对称。
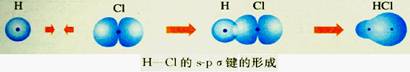
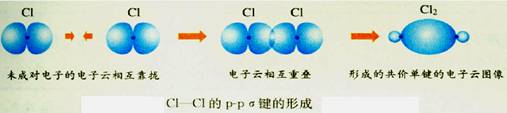
③种类:s-s σ键、s-p σ键、p-p σ键。
H2分子里的共价键H-H 键是由两个s电子重叠形成的,称为s-s σ键。
HCl分子中的共价键H-Cl键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成的,称为s-p σ键。
Cl2分子中的共价键Cl-Cl键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的,称为p-p σ键。
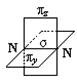
(2)π键
①概念:两个原子的P原子轨道以平行或“肩并肩”的方式重叠。
②特征:每个π键的电子云有两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜像对称。
(3)σ键和π键比较
①重叠方式: σ键:头碰头;π键:肩并肩。σ键可以旋转而π键不能旋转。
②电子云重叠程度:σ键>π键;
键的强度:σ键>π键;
键的稳定性:σ键>π键。
π键的电子活性较高,它是化学反应的积极参加者,因而含有π键的化合物与只有σ键的化合物的化学性质不同,如乙烷和乙烯的性质不同。
③成键电子:σ键 s-s s-p p-p π键 p-p
④共价键的组成:单键 — σ键;双键 — 一个σ键和一个π键;
三键 — 一个σ键和两个π键。
3、共价键的特征:饱和性、方向性。
一个原子的未成对电子一旦与另一个自旋相反的未成对电子成键后,就不能再与第三个电子配对成键,因此,一个原子有几个不成对电子,就会与几个自旋相反的未成对电子成键,这就是共价键的饱和性。
形成共价键时,原子轨道重叠的程度越大越好,而原子轨道具有一定的伸展方向,为了达到原子轨道的最大重叠程度,成键原子必须沿着一定的方向进行原子轨道的重叠形成的分子才稳定,这就是共价键的方向性。
讨论:
(1)已知氮分子的共价键是三键(N≡N),通过画图来描述。
N:1s22s22p3
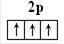
(2)钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?请从原子的电负性差别来解释。
原子 |
NaCl |
HCl |
CO |
电负性 |
0.93.0 |
2.13.0 |
2.53.5 |
电负性之差(绝对值) |
2.1 |
0.9 |
1.0 |
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。 |
|||
(3)乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
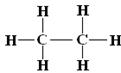
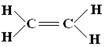
乙烷 乙烯 乙炔
1个C-C σ键, 1个C-C σ键, 1个C-C σ键,
6个C-H σ键 1个C-Cπ键, 2个C-Cπ键,
4个C-H σ键 2个C-H σ键
课堂练习:
1、下列有关共价键的叙述中,不正确的是( )
A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数
B.水分子内氧原子结合的电子数已经达到饱和,故不能再与氢原子形成共价键
C.非金属元素原子之间形成的化合物也可能是离子化合物
D.所有简单离子的核电荷数与其核外电子数一定不相等
答案:A
解析:
非金属元素的原子形成的共价键数目取决于该原子最外层的不成对电子数,一般最外层有几个不成对电子就能形成几个共价键,A错。一个原子的未成对电子一旦与另一个自旋相反的未成对电子成键后,就不能再与第三个电子配对成键,因此,一个原子有几个不成对电子,就会与几个自旋相反的未成对电子成键,这就是共价键的饱和性,故一个氧原子只能与两个氢原子结合生成H2O,B正确。非金属元素原子之间形成的化合物也可能是离子化合物,如NH4Cl等铵盐。不管是阴离子还是阳离子,核内质子数与核外电子数必定存在差别。此差值就是离子所带的电荷数。
2、下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
答案:B
3、下列物质的分子中既有σ键,又有π键的是( )
①HCl;②H2O;③N2;④H2O2;⑤C2H4;⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑥ D.③⑤⑥
答案:D
解析:
共价键尽可能沿着原子轨道重叠最大的方向形成,这样原子轨道重叠越多,形成的键越牢固。其中σ键是原子轨道以“头碰头”的方式成键,π键是原子轨道以“肩并肩”的方式成键,σ键比π键强。当两个原子间能形成多个共用电子对时,先形成一个σ键,另外的原子轨道只能形成π键。N2中有三个共价键;一个σ键,两个π键;C2H4中碳碳原子之间有两个共价键:一个σ键,一个π键;C2H2中碳碳原子之间有三个共价键:一个σ键,两个π键。
4、σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是( )
A.H2 B.HCl
C.Cl2 D.F2
答案:B
5、共价键是有饱和性和方向性的,下列关于共价键这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的方向性决定了分子的立体构型
E.共价键的饱和性与原子轨道的重叠程度有关
F.硫化氢分子中的两个共价键的夹角与硫原子的两个未成对电子所在的原子轨道的夹角有关
答案:E
解析:
一般情况下,原子的未成对电子一旦配对成键,就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数目决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A、C正确;形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向间存在着必然的联系,这种成键的方向性就决定了所形成分子的构型,故B、D、F正确。E是错误的。
6、下列说法正确的是( )
A.离子键具有饱和性和方向性
B.在形成离子键时,原子总是尽可能沿着原子轨道最大重叠的方向成键
C.s轨道与s轨道之间可以在任何方向上成键,所以共价键没有方向性
D.s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键
答案:D
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -