我们通常讲的原子半径,是通过晶体分析,根据两个相邻原子的平均核同距测定的。由于核外电子并没有严格固定的运动轨道,电子云也没有明确的边界,实际上无法精确地测量核至最外层电子的平均距离,因而有关原子半径的数值只有相对的近似意义。一般经常使用的原子半径有三组数据;一组是共价半径数据,另一组是范德华半径。一般称范氏半径,第三组为金属半径。
1、共价半径
即同种元素的两原子以共价键结合时,两核间距离的一半。实际上核间距离即是共价键的键长,所以此时半径为键长的一半(r=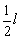 )。
)。
2、范氏半径
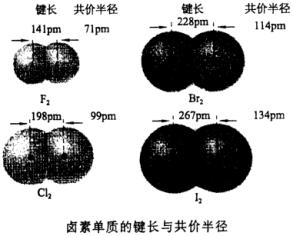
靠范德华力(分子间作用力)相互吸引的相邻的不同种分子中的两个相同原子核间距离的一半。
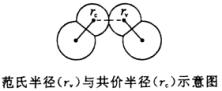
由于范德华力相对于化学键来说很弱,所以范氏半径一般大于共价半径。如在同周期中原子半径呈由大到小的变化趋势,但到稀有气体元素时其原子半径却突然增大,实际是前者为共价半径数据,后者为范氏半径数据的缘故。
3、金属半径:金属晶体中相邻两个金属原子核间距离的一半称作金属半径。
一般地,原子的金属半径比共价半径大些,这是因为形成共价键时,轨道重叠程度大些。而范德华半径的值总是较大。因为分子间作用力不能将分子拉得紧密。