1.下列事实中能证明氯化氢是共价化合物的是( )
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
2.下列过程中,共价键被破坏的是( )
A.碘升华 B.碘蒸气被木炭吸附
C.蔗糖溶于水 D.HCl气体溶于水
3.人们在研究金星大气成分,发现金星大气中有一种称之为硫化羟(COS)的分子,其结构与CO2类似,硫化羟是一种与生命密切相关的物质。下列有关COS的推测肯定不正确的是( )
A.COS属于离子化合物
B.COS分子中,所有原子都满足8电子的稳定结构
C.COS的结构式为O=C—S
D.COS含有共价键
4.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.溴和苯分别受热变成气体
B.干冰和氯化铵分别受热变成气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
5.从电负性角度来判断下列元素之间易形成共价键的是( )
A.Na和Cl B.Cl和H
C.Na和H D.I和Br
6.下列分子中,只有σ键而没有π键的是( )
A.CH4 B.CH3CH3
C.CH2=CH2 D.CH≡CH
7.下列说法中正确的是( )
A.p轨道之间以“肩并肩”重叠可形成σ键
B.p轨道之间以“头碰头”重叠可形成π键
C.s和p轨道以“头碰头”重叠可形成σ键
D.共价键是两个原子轨道以“头碰头”重叠形成的
8.在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
9、下列分子中存在的共价键的类型完全相同的是( )
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
10.(1)像H2分子这样,______________________________叫做共价键,其本质是__________。
(2)按共价键的共用电子对理论,不可能有H3、H2Cl、和Cl3分子,这表明共价键具有__________,除了这一特征外,共价键还具有__________特征。
(3)σ键的特征是:以形成__________的两原子核的连线为轴作旋转操作,共价键的电子云__________。
(4)HCl分子里的共价键是由氢原子提供的未成对电子__________原子轨道和氯原子提供的未成对电子__________原子轨道重叠形成的。这样的σ键称为__________。σ键还包括__________、__________。
(5)水分子是H2O而不是H3O,是因为共价键具有__________性。
显示答案
|
10.(1)原子间通过共用电子对所形成的相互作用;电子云重叠
(2)饱和性;方向性
(3)化学键;图像不变
(4)s;p; s—p σ键; s—s σ键;p—p σ键
(5)饱和 |
11.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为__________,CO分子里的共价键有__________。
②金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,它在423K就分解为Ni和CO,从而制得高纯度的Ni粉。Ni(CO)4易溶于下列__________。
a.水 b.四氯化碳
c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态电子排布式是。31Ga的第一电离能却明显低于30Zn,原因是________
____________。
显示答案
|
11.(1)①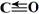 ;σ键、π键;②bc ;σ键、π键;②bc
(2)1s22s22p63s23p63d104s24p1;
31Ga失去1个电子后内层电子达到全充满的稳定状态。 |