| 键参数和等电子原理 |
主编:黄冈中学化学集体备课组
一、键参数
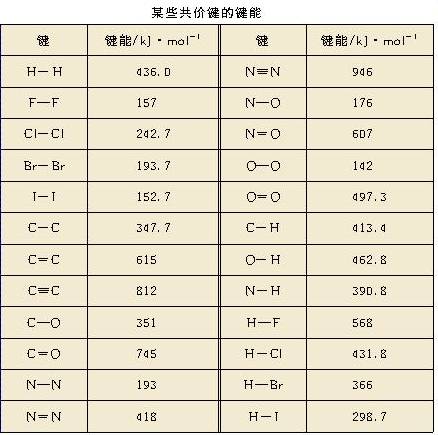
1、键能
(1)概念:气态基态原子形成1mol化学键所释放出的最低能量。
单位:kJ/mol。
思考:①键能大小与键的强度有何关系?
②键能与化学反应的能量变化有何关系?
(2)意义:键能越大,化学键越稳定,越不易断裂,形成化学键放出的能量越大。
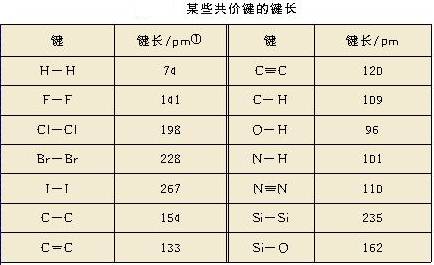
2、键长
(1)概念:形成共价键的两原子间的核间距。
单位:pm(1pm=10-12m)。
(2)意义:键长越短,共价键越牢固,共价键越稳定。
3、键角:多原子分子中的两个共价键之间的夹角。
例如:CO2结构为O=C=O,键角为180°,为直线形分子。
H2O的H-O-H键角为105°,为V形分子。
CH4的H-C-H键角109°28′,为正四面体形分子。
小结:
①键能、键长、键角是共价键的三个参数。
②键能、键长决定了共价键的稳定性:键长越短,键能越大,共价键越稳定。
③键长、键角决定了分子的空间结构。
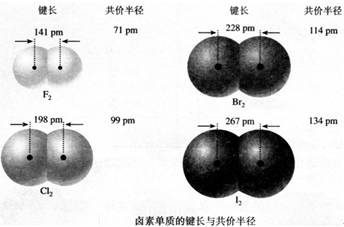
资料卡片:共价半径
思考:
(1)试利用表中的数据进行计算:1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别形成2molHCl分子和2molHBr分子,哪一个反应释放的能量更多?如何用计算的结果说明HCl分子和HBr分子哪个更容易发生热分解生成相应的单质?
分析:
H-H (436) ;Cl-Cl(242.7) ;Br-Br(193.7) ; H-Cl(431.8) ;H-Br(366)
1molH2跟1molCl2形成2molHCl分子释放的能量:
2×431.8kJ - 1×436kJ - 1×242.7kJ=184.9kJ
1molH2跟1molBr2(蒸汽)反应形成2molHBr分子释放的能量:
2×366kJ - 1×436kJ - 1×193.7kJ=102.3kJ
显然生成HCl释放的能量更多。由于生成HBr释放的能量少,HBr的稳定性比HCl差,HBr分子更容易发生热分解。
(2)N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
分析:
N≡N键、O=O键、F-F键的键能(946kJ/mol、497.3 kJ/mol、157 kJ/mol)依次减小,与H2反应时打破这些键越来越易,同时,N-H键、O-H键、F-H键的键能(390.8 kJ/mol、462.8 kJ/mol、568 kJ/mol)依次增大,形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2跟H2的反应能力依次增强。
(3)通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
分析:
分子的键长越短,键能越大,该分子越稳定。
二、等电子原理
CO和N2的某些性质
分子
熔点/℃
沸点/℃
在水中的溶解度(室温)
分子离解能
(kJ·mol-1)
分子的价电子总数
CO
-205.05
-191.19
2.3mL
1075
10
N2
-210.00
-195.81
1.6mL
946
10
1、等电子原理:原子总数相同,价电子总数相同的分子(微粒),具有相似的化学键特征,性质相似。
2、等电子体:原子总数相同,价电子总数相同的分子(微粒)。
等电子体结构相似,性质相似。
如:CO和N2,CH4和NH4+,CO2和CS2。
(板书有误:此处视频中分子离解能单位为kJ·mol-1,误写成了“kJ·mol”。)
课堂练习:
1.下列分子中,两核间距最大,键能最小的是( )
A.H2 B.Br2
C.Cl2 D.I2
答案:D
2.下列说法中,错误的是( )
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
答案:A
3.能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
答案:A
4.与NO3-互为等电子体的是( )
A.SO3 B.BF3
C.CH4 D.NO2
答案:AB
5.根据等电子原理,下列分子或离子与SO42-有相似结构的是( )
A.PCl5 B.CCl4
C.NF3 D.N2
答案:B
6.下列物质性质的变化规律,与共价键的键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
答案:BC
7.H-H的键能为436kJ/mol,它所表示的意义是________。如果要使1molH2分解为2molH原子,你认为是吸收能量还是放出能量?________。能量数值________。当两个原子形成共价键时,原子轨道重叠的程度越大,共价键的键能________,两原子核间的平均距离――键长________。
答案:
(每2mol气态H原子形成1mol H2释放出436 kJ能量 吸收能量 436 kJ 越大 越短)
8.根据课本中有关键能的数据,计算下列反应中的能量变化:
(1)N2(g)+3H2(g)=2NH3(g)
(2)2H2(g)+O2(g)=2H2O(g)
答案:
(1)△H=-90.8kJ/mol;(2)△H=-481.9 kJ/mol 。
(板书有误:此处视频解析中键能单位为kJ·mol-1,误写成了“J·mol”。)
9.由N2和H2每生成1molNH3放热46kJ,而每生成1molNH2-NH2却吸收96.1kJ,又知H-H键键能为436.0kJ/mol,N≡N三键键能为940.0kJ/mol,
试求:(1)N-H键的键能。(2)N-N单键的键能。
答案:
(1)390 (2)191
10、1919年,Langmuir提出等电子原理、原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是__________和__________;__________和__________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有__________、__________。
答案:
(1)CO N2 CO2 N2O (2)O3 SO2
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -