1.根据下表中所列键能的数据,判断下列分子中,最不稳定的是( )
化学键 |
H—H |
H—Cl |
H—Br |
Br—Br |
键能/kJ·mol-1 |
436 |
431 |
363 |
193 |
A.HCl B.HBr
C.H2 D.Br2
2.下列分子中键能最大的是( )
A.HF B.HCl
C.HBr D.HI
3.下列分子稳定性大小比较不正确的是( )
A.HF>HI B.CH4<SiH4
C.PH3<NH3 D.H2O>H2S
4.能够用键能解释的是( )
A.氯化氢的化学性质比碘化氢稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很雉发生化学反应
D.硝酸易挥发,硫酸难挥发
5.根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(g)△H=-Q,Q值大于297.23kJ/mol
B.S(s)+O2(g)=SO2(s)△H=-Q,Q值小于297.23kJ/mol
C.1mol SO2的键能总和大于1mol S和1mol O2的键能之和
D.1mol SO2的键能总和小于1mol S和1mol O2的键能之和
6.下列说法中,正确的是( )
A.在N2分子中,两个原子的总键能是单个键能的三倍
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个σ键、一个π键
D.N2分子中存在一个σ键、一个π键
7.下表所列是不同物质中O—O键的键长和键能数据,其中a和b未测出。根据一个原则可以估计键能d>c>b>a,该原则是( )
|
O22- |
O2- |
O2 |
O2+ |
键长(pm) |
149 |
128 |
121 |
112 |
键能(kJ·mol-1) |
a |
b |
c=494 |
d=628 |
A.成键电子数越少键能越大
B.成键电子数越多键能越大
C.键长越短的其键能越大
D.以上都不是
8.与NO3-互为等电子体的是( )
A.SO3 B.BF3
C.CH4 D.NO2
9.能说明BF3分子的4个原子是同一平面的理由是( )
A.键与键之间的夹角为120° B.B—F键为非极性共价键
C.3个B—F键的键能相同 D.3个B—F键的键长相等
10.下列各说法中正确的是( )
A.分子中键能越高,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463kJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463kJ
11.(1)__________和__________是衡量共价键稳定性的参数。
(2)键长是形成共价键的两个原子之间的__________间距。键长越长,键能越__________(填“大”或“小”),键越__________断裂,化学性质越__________(填“稳定”或“不稳定”)。
(3)键能越大,即形成化学键时放出的能量越__________(填“大”或“小”),意味着这个化学键越__________(填“稳定”或“不稳定”)。
(4)键角是描述__________的重要参数,分子的许多性质都与键角有关。CO2是__________形分子,键角__________。H2O是__________分子,键角__________。
显示答案
|
11.(1)键能;键长
(2)核;小;易;不稳定
(3)大;稳定
(4)分子空间构型;直线; 180°;V形; 105° |
12.已知某些共价键的键能,试回答下列问题:
共价键 |
键能/kJ·mol-1 |
共价键 |
键能/kJ·mol-1 |
H—H |
436 |
O—H |
464 |
Cl—Cl |
243 |
N≡N |
946 |
C—H |
413 |
H—Cl |
432 |
(1)H—H的键能为什么比Cl—Cl的键能大?
______________________________________________________________________。
(2)已知H2O在2000℃时有5%的分子分解,而CH4在1000℃时可能完全分解为C和H2,试解释其中的原因。
______________________________________________________________________。
(3)试解释氮气为什么能在空气中稳定存在?
______________________________________________________________________。
显示答案
|
12.(1)H原子的半径比Cl原子半径小,故H—H的键长比Cl—Cl键长短,H—H的键能比Cl—Cl键能大
(2)H—O比H—C键能大,故H2O比CH4稳定
(3)N2存在氮氮三键,键能大,故结构稳定 |
13.下表是一些键能的数据(单位:kJ·mol-1):
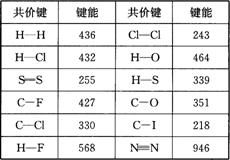
回答下列问题:
(1)一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物的键能之间有密切的关系。由表中数据计算下列热化学方程式中的热效应:
H2(g)+Cl2(g)=2HCl(g)△H=__________。
(2)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应时(RX+NaOH→R—OH+NaX),则RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是____________________。
(3)试预测C—Br键的键能范围(写具体数值)__________<C—Br键能<__________。
显示答案
|
13.(1)-185kJ·mol-1
(2)RF<RCl<RBr<RI
(3)218kJ·mol-1;330kJ·mol-1 |
14.1919年,Langmuir提出等电子原理、原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是__________和__________;__________和__________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有__________、__________。
显示答案
|
14.(1)CO;N2;CO2;N2O
(2)O3;SO2 |