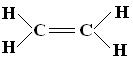| 杂化轨道理论简介 |
主编:黄冈中学化学集体备课组
1、杂化与杂化轨道的概念
杂化:在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫杂化。
杂化轨道:通过杂化形成的新轨道称为杂化轨道。
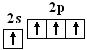
如C和H在形成甲烷分子时,C原子发生了杂化:
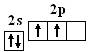
C:
(能量介于2s、2p之间)
基态 激发态 杂化态
C原子发生了杂化时,电子激发时所需的能量能由成键时释放出来的能量予以补偿,组成四个新的能量相等、成分相同的杂化轨道。四个sp3杂化轨道分别指向正四面体的四个顶角,杂化轨道间的夹角为109°28′,呈正四面体。
当C原子跟4个氢原子结合时,C原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—Hσ键。由于C原子的四个sp3杂化轨道呈正四面体,因此甲烷分子呈正四面体构型。
总结杂化理论要点:
(1)轨道杂化时,通常存在激发、杂化、轨道重叠等过程。
(2)原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
(板书有误:此处视频中误将“发生”写成了“分生”。)
(3)只有能量相近的原子轨道才能发生杂化,如2s、2p,3d、4s,而1s、2p却不能。
(4)杂化轨道数目与组成杂化轨道的各原子轨道数目相等,即杂化过程中轨道总数保持不变。
(5)杂化轨道成键时,要满足原子轨道最大重叠原理,一般形成σ键。由于杂化轨道电子云更集中,因此杂化轨道成键能力比各原子轨道的成键能力强,因而形成的分子更稳定。
(6)杂化轨道成键时,要满足化学键间最小排斥原理,这决定了杂化轨道的空间构型,即决定了分子的空间构型。
2、杂化轨道的类型
根据原子轨道的种类和数目的不同,可以组成不同类型的杂化轨道:
(1)sp3杂化
杂化的轨道:1个ns和3个np。
杂化轨道特点:轨道间夹角为109°28′,空间构型为四面体。
例如:H2O、NH3、SO42-、PO43-、ClO4-的中心原子O、N、S、P、Cl均采取了sp3杂化。
(2)sp2杂化
杂化的轨道:1个ns和2个np。
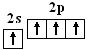
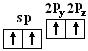
如C和H在形成C2H4分子时,C原子发生了sp2杂化:
C:
基态 激发态 杂化态
杂化轨道特点:3个sp2杂化轨道在空间以中心原子为中心指向平面三角形的3个顶点,轨道间夹角为120°,空间构型呈平面三角形。另1个中心原子的Pz轨道以中心原子为中心垂直于3个sp2杂化轨道形成的平面。(展示sp2杂化轨道模型)
讨论:C2H4分子结构。
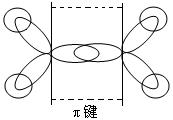
4个C-Hσ键,1个C-Cσ键,1个C-Cπ键 乙烯,平面型分子
再如:CH2O、BF3、CO32-、NO3-的中心原子C、B、C、N均采取了sp2杂化。
(3)sp杂化
杂化的轨道:1个ns和1个np。
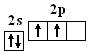
如C和H在形成C2H2分子时,C原子发生了sp杂化:
C:
基态 激发态 杂化态
杂化轨道特点:2个sp杂化轨道间夹角为180°,空间构型呈直线形。另2个中心原子的P轨道以中心原子为中心与直线形的sp杂化轨道相互垂直。(展示sp杂化轨道模型)
讨论:C2H2分子结构。
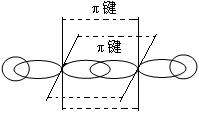
2个C-Hσ键,1个C-Cσ键,2个C-Cπ键 乙炔,直线型分子
再如:CO2、CS2、BeCl2的中心原子C、C、Be均采取了sp杂化。
说明:还有其他杂化轨道类型如sp3d2杂化、sp3d杂化、dsp2杂化等,同学们不作掌握。
3、应用价层电子对互斥理论和轨道杂化理论,探究分子的立体结构
思考:说明CO2、H2O、NH3、CH4分子中键合情况。
CO2:O=C=O ,2个C-Oσ键、2个C-Oπ键
H2O:
, 2个O-H σ键
NH3:
,3个N-H σ键
CH4:
,4个C-H σ键
(1)中心原子的杂化轨道类型的判断方法:依价层电子对互斥理论判断价层电子对数→中心原子价层电子对数=杂化轨道数→判断杂化轨道类型。
(2)杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对,sp、sp2杂化中未参与杂化的P轨道可用于形成π键。
(3)依价层电子对互斥理论和轨道杂化理论判断分子的立体结构和原子间的键合情况。
[例题]填写下列表格
化学式 |
中心原子价层电子对数(孤电子对数) |
中心原子杂化轨道类型 |
分子结构 |
原子间的键合情况 |
NH4+ |
4(0) |
sp3 |
正四面体 |
4个N-H σ键 |
PH3 |
4(1) |
sp3 |
三角锥形 |
3个P-H σ键 |
BF3 |
3(0) |
sp2 |
平面形 |
3个B-Fσ键( π键复杂) |
CH2O |
3(0) |
sp2 |
平面形 |
2个C-Hσ键、1个C-O σ键、 1个C-O π键 |
BeCl2 |
2(0) |
sp |
直线形 |
2个Be—Cl σ键 |
CH3Cl |
4(0) |
sp3 |
四面体形 |
3个C-Hσ键、1个C-Cl σ键 |
NF3 |
4(1) |
sp3 |
三角锥形 |
3个N-F σ键 |
随堂练习:
1.下列分子中心原子是sp2杂化的是( )
A.PBr3 B.CH4
C.BF3 D.H2O
答案:C
2.关于原子轨道的说法正确的是( )
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
答案:C
3.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
答案:A
4.乙烯分子中含有4个C-H和1个C=C双键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是( )
A.每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道
B.每个C原子的1个2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道
C.每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道
D.每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
答案:BD
5.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
微粒 |
ClO- |
ClO2- |
ClO3- |
ClO4- |
立体结构 |
直线 |
V型 |
三角锥形 |
正四面体 |
6.填写下列表格
化学式 |
中心原子价层电子对数(孤电子对数) |
中心原子杂化轨道类型 |
分子结构 |
原子间的键合情况 |
H2S |
4(2) |
sp3 |
V形 |
2个S-Hσ键 |
H3O+ |
4(1) |
sp3 |
三角锥形 |
3个O-Hσ键 |
CO32- |
3(0) |
sp2 |
平面形 |
3个C-Oσ键(π键复杂) |
SnBr2 |
3(1) |
sp2 |
V形 |
2个Sn—Brσ键 |
CS2 |
2(0) |
sp |
直线形 |
1个C-Sσ键、1个C-Sπ键 |
HCN |
2(0) |
sp |
直线形 |
1个C-Hσ键、1个C-Nσ键、 2个C-N π键 |
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -