具有相同的通式——AXm,而且价电子总数相等的分子或离子具有相同结构特征,这个原理称为“等电子原理”。这里的“结构特征”的概念既包括分子的立体结构,又包括化学键的类型,但键角并不一定相等,除非键的180°或90°等特定的角度。
(1)CO2、CNS-、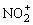 、
、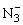 具有相同的通式——AX2,价电子总数16,具有相同的结构——直线形分子,中心原子上没有孤对电子而取sp杂化轨道,形成直线形σ骨架,键角为180°,分子里有两套
具有相同的通式——AX2,价电子总数16,具有相同的结构——直线形分子,中心原子上没有孤对电子而取sp杂化轨道,形成直线形σ骨架,键角为180°,分子里有两套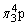 —大π键。
—大π键。
(2)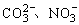 、SO3等离子或分子具有相同的通式——AX3,总价电子数24,有相同的结构——平面三角形分子,中心原子上没有孤对电子而取sp2杂化轨道形成分子的σ骨架,有一套
、SO3等离子或分子具有相同的通式——AX3,总价电子数24,有相同的结构——平面三角形分子,中心原子上没有孤对电子而取sp2杂化轨道形成分子的σ骨架,有一套 —p大π键。
—p大π键。
(3)SO2、O3、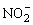 等离子或分子具有相同的通式——AX2,总价电子数为18,中心原子取sp2杂化形式,VSEPR理想模型为平面三角形,中心原子上有1对孤对电子(处于分子平面上),分子立体结构为V形(或角形、折线形),有一套符号为
等离子或分子具有相同的通式——AX2,总价电子数为18,中心原子取sp2杂化形式,VSEPR理想模型为平面三角形,中心原子上有1对孤对电子(处于分子平面上),分子立体结构为V形(或角形、折线形),有一套符号为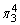 的p—p大π键。
的p—p大π键。
(4)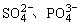 等离子具有AX4的通式,总价电子数32,中心原子有4个σ键,故取sp3杂化形式,呈正四面体立体结构;请注意:这些离子的中心原子的所有3p轨道都参与杂化了,都已用于形成σ键,因此,分子里已经不可能存在中心原子的p轨道参与的p—pπ键,它们的路易斯结构式里的重键是d—p大π键,不同于p—pπ键,是由中心原子的d轨道和配位原子的p轨道形成的大π键。
等离子具有AX4的通式,总价电子数32,中心原子有4个σ键,故取sp3杂化形式,呈正四面体立体结构;请注意:这些离子的中心原子的所有3p轨道都参与杂化了,都已用于形成σ键,因此,分子里已经不可能存在中心原子的p轨道参与的p—pπ键,它们的路易斯结构式里的重键是d—p大π键,不同于p—pπ键,是由中心原子的d轨道和配位原子的p轨道形成的大π键。
(5)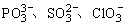 等离子具有AX3的通式,总价电子数26,中心原子有4个σ轨道(3个σ键和1对占据σ轨道的孤对电子),VSEPR理想模型为四面体,(不计孤对电子的)分子立体结构为三角锥体,中心原子取sp3杂化形式,没有p—pπ键或p—p大π键,它们的路易斯结构式里的重键是d—p大π键。
等离子具有AX3的通式,总价电子数26,中心原子有4个σ轨道(3个σ键和1对占据σ轨道的孤对电子),VSEPR理想模型为四面体,(不计孤对电子的)分子立体结构为三角锥体,中心原子取sp3杂化形式,没有p—pπ键或p—p大π键,它们的路易斯结构式里的重键是d—p大π键。