例1、(四川卷)25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l);△H=-57.3kJ/mol
B.KOH(aq)+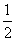 H2SO4(aq)=
H2SO4(aq)=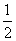 K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
C.C8H18(l)+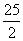 O2(g)=8CO2(g)+9H2O(g);△H=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g);△H=-5518kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);△H=-5518kJ/mol
 解析:
解析:
A项不符合中和热的定义;C项中生成物H2O的状态应为液态;D项中辛烷的物质的量不是1mol。
 答案:B
答案:B
例2、(江苏卷)下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
解析:
①中,△H均为负值,△H1=2△H2,△H1<△H2,不合题意;②中S(s)→S(g)要吸收热量,后者反应放出的热量更多,故△H3>△H4;③由于反应式中的计量数不同,由于反应放热,△H<0,计量数大的热化学方程式,△H就越小,故△H5>△H6;④中前一反应△H>0,后一反应△H<0,即△H7>△H8,故②③④均符合题意。
答案:C
点评:
本题考查热化学方程式的意义,理解热化学方程式的意义,掌握常见反应的热效应规律是解题的关键。