| 化学反应与能量变化 |
主编:黄冈中学化学集体备课组
(引)前面我们学过化学反应中,除了有新物质生成,同时还伴随有能量变化。这种能量变化通常以热量的形式表现出来,如铝片与盐的反应时放出热量,称为放热反应;而NH4Cl(s)晶体与Ba(OH)2·8H2O晶体迅速搅拌下反应吸收热量,称为吸热反应。化学反应过程中放出或吸收的热量通常叫反应热。恒压条件下的反应热可以用生成物与反应物的焓的差值来表示,即焓变△H表示。
一、反应热(焓变)
1、化学反应中放出或吸收的热量叫反应热。符号:△H , 单位:kJ·mol-1
(讲)化学反应的反应热有的可以通过实验直接测得。
(板书)测量仪器:量热计
(讲)研究某反应时,我们通常将被研究的物质系统称为体系,体系以外的其它部分称为环境。对于放热的,由于反应后放出能量,一部分能量传递给环境,而使体系的能量降低,所以△H记为“-”或“△H<0”。而反之对于吸热反应,反应吸收外界能量,体系的能量升高了。所以△H记为“+”或“△H>0”。
(板书)2、规定:放热反应,△H为“-”或△H<0
吸热反应,△H为“+”或△H>0
如:(副版)H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1
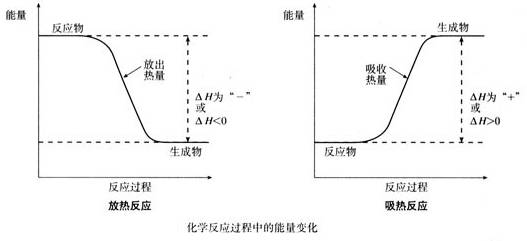
(讲)化学变化过程中的能量变化如图所示。
放热反应,∑E反>∑E生,△H <0;
吸热反应,∑E反<∑E生,△H>0。
3、△H=∑E生-∑E反,或△H=∑反应物总键能-∑生成物总键能。
(过渡)如何将反应热用式子表示出来呢?
二、热化学方程式
1、热化学方程式:表明反应放出或吸收热量的化学方程式。
如:
讲明热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化情况。
2、热化学方程式的书写
(讲)与普通化学方程式相比,书写热化学方程式除了要遵循化学方程式的要求外,还应注意以下几点:
(1)需注明△H的“+”与“-”,且写在方程式的右边,用“空格”隔开。
(要注明反应的温度和压强,因反应的温度和压强不同时,△H也不同。但中学所用的△H的数据,一般都是在101kPa和25℃的数据,因此可不特别注明)
(2)要注明反应物和产物的聚集状态(物质状态不同,反应热△H不同)
如:H2(g)+
=H2O(g) △H=-241.8kJ·mol-1
H2(g)+
=H2O(l) △H=-285.8kJ·mol-1
一般气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。
热化学方程式不写反应条件,不标“↓”“↑”等符号。
(3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量。因此,可以是整数,也可以是分数。对于同一个反应,当化学计量数不同时,其△H也不同,△H与化学计量数成正比。
如:H2(g)+Cl2(g)=2HC(g);△H=-184.6kJ·mol-1
;△H=-92.3kJ·mol-1
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ·mol-1
H2(g)+
=
;△H=-241.8kJ·mol-1
(4)当反应逆向进行时,其反应热与正反应的反应的数值相等,符号相反。
如:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ·mol-1
2H2O(l)=2H2(g)+O2(g);△H=+571.6kJ·mol-1
练习:
1、已知:
(1)H2(g)+
=H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+
=H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(g) △H4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
解析:
由氢气燃烧为放热反应可知,a、b、c、d均小于0,B、D错误。H2O(g)=H2O(l) △H<0,为放热过程。由(1)、(3)知,|c|>|a|>0,所以c<a<0,A错。由(1)×2知:2H2(g)+O2(g)=2H2O(g) △H=2a kJ·mol-1,2a=b且二者均小于0,所以C正确。
答案:C。
2、完全燃烧一定质量的无水乙醇,生成CO2(g)和H2O(l),放出的热量为Q kJ,为完全吸收生成的CO2,并使之生成正盐,消耗掉0.8mol·L-1 NaOH溶液500mL,则燃烧1mol酒精生成CO2(g)和H2O(l)的热化学方程式为____________________________。
解析:
CO2 + 2NaOH = Na2CO3 + H2O
1 2
0.2mol 0.8×0.5=0.4mol
根据C元素守恒得:
C2H5OH ~ 2CO2
1 2
0.1mol 0.2mol
0.1mol C2H5OH~Q kJ
1mol C2H5OH~10Q kJ
答案:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-10Q kJ·mol-1。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -