1、下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
2、下列说法正确的是( )
A.物质发生化学反应都伴有能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量总高于生成物的总能量
D.在一个确定的化学反应关系中,生成物的总能量总高于反应物的总能量
3、下列变化过程,属于放热反应的是( )
①液态水变成水蒸气;②酸碱中和反应;③浓H2SO4稀释;④固体NaOH溶于水;⑤H2在Cl2中燃烧
A.②③④⑤ B.②③④
C.②⑤ D.①③⑤
4、下列叙述中正确的是( )
A.葡萄糖在人体内氧化分解是放热反应
B.酸碱中和反应是吸热反应
C.木柴燃烧需要用火柴点燃,所以木柴燃烧是吸热反应
D.苛性钠溶于水是放热反应
5、根据下图提供的信息,下列所得结论不正确的是( )
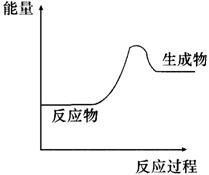
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为反应物的总能量低于生成物的总能量,所以该反应需要加热才能发生
6、已知H—H键能为436kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2+3H2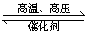 2NH3 △H=-92.4kJ/mol,则N≡N键的键能是( )
2NH3 △H=-92.4kJ/mol,则N≡N键的键能是( )
A.431kJ/mol B.946kJ/mol
C.649kJ/mol D.869kJ/mol
7、在一定条件下合成氨的热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ/mol。在相同条件下,向密闭容器中加入2mol N2和6mol H2,充分反应后,对放出的热最描述一定正确的是( )
A.92.4kJ~184.8kJ B.大于92.4kJ
C.等于184.8kJ D.小于184.8kJ
8、在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
A.2H2(g)+O2(g)=2H2O(l) △H1
2H2(g)+O2(g)=2H2O(g) △H2
B.S(g)+O2(g)=2SO2(g) △H1
S(s)+O2(g)=2SO2(g) △H2
C.C(s)+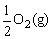 =CO(g) △H1
=CO(g) △H1
C(s)+O2(g)=CO2(g) △H2
D.H2(g)+Cl2(g)=2HCl(g) △H1
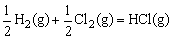 △H2
△H2
9、已知在1×105Pa,298K条件下,1g H2燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
C.2H2+O2=2H2O △H=-571.6kJ/mol
D.H2(g)+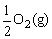 =H2O(g) △H=-285.8kJ/mol
=H2O(g) △H=-285.8kJ/mol
10、下列说法或表示错误的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.反应H2(g)+Cl2(g)=2HCl(g) △H1和H2(g)+Br2(g)=2HBr(g) △H2,则△H1>△H2
C.稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
D.已知氧气较臭氧稳定,则3O2(g)=2O3(g) △H>0
13、已知破坏1mol化学键所消耗的能量和形成1mol该化学键所放出的能量相等,这部分能量称作键能。下表中的数据是各种化学键的键能(kJ),根据表中数据回答下列问题。
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
键能(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
(1)下列氢化物中最稳定的是__________。
①HCl ②HBr ③HI
(2)下列物质查身具有的能量由低到高的顺序是__________。
①H2 ②Cl2 ③Br2 ④I2
(3)Br2+H2=2HBr的反应是吸热反应还是放热反应,其数值是多少?答:__________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应:X2+H2=2HX,当消耗等物质的量氢气时,能量变化最大的反应是__________。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答:__________,你的根据是____________________。