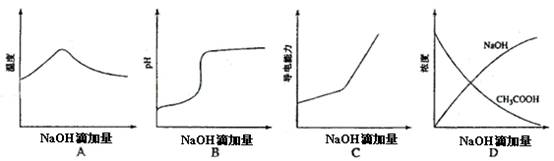
例1、(宁夏)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
解析:
A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低。B选项醋酸中滴加氢氧化钠酸性减弱,pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,但氢氧化钠浓度不会一直增大,最后会呈基本水平走势,所以D错误。
答案:D
例2、(上海)根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

 A.c(HCO3-)>c(ClO-)>c(OH-)
A.c(HCO3-)>c(ClO-)>c(OH-)
 B.c(ClO-)>c(HCO3-)>c(H+)
B.c(ClO-)>c(HCO3-)>c(H+)
 C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
 D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
解析:
由表中数据可知,H2CO3的酸性大于HClO,HClO的酸性大于HCO3-的酸性,则ClO-的水解程度大于HCO3-,故A项正确, B项错误。根据物料守恒和电荷守恒判断,C项和D项等式右边都漏掉了CO32-的浓度,故均错误。
答案:A
例3、(天津)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
 A.均存在电离平衡和水解平衡
A.均存在电离平衡和水解平衡
 B.存在的粒子种类相同
B.存在的粒子种类相同
 C.c(OH-)前者大于后者
C.c(OH-)前者大于后者
 D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
解析:
NaHCO3和Na2CO3溶液溶液都存在水解不容置疑,但是A容易被误选,因为很多考生认为Na2CO3溶液中只有碳酸根离子水解,而忽视了水的电离;B选项中两溶液中均存在:HCO3-、CO32-、H2CO3、OH-、Na+、H+、H2O,因此B正确。因为CO32- 水解能力大于HCO3-,所以Na2CO3溶液碱性更强,因而C错误。CO32-水解溶液呈碱性,加碱可以抑制水解,使c(CO32-)增大,而NaHCO3直接与NaOH反应生成Na2CO3,使c(CO32-)增大 ,所以D正确。
答案:C
例4、(全国卷I)在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH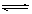 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
解析:根据CH3COOH溶液中的电离平衡:CH3COOH CH3COO―+H+,加入水时,CH3COOH的浓度变稀,有利于电离平衡向正反应方向移动;加入少量NaOH固体时,NaOH与CH3COOH电离产生的H+反应,使其电离平衡向正反应方向移动;加入0.1mol/L HCl溶液,增加了溶液中的c(H+)浓度,但其平衡向逆反应方向移动;加入CH3COONa固体,增加了溶液中CH3COO―浓度,使平衡向逆反应方向移动。
CH3COO―+H+,加入水时,CH3COOH的浓度变稀,有利于电离平衡向正反应方向移动;加入少量NaOH固体时,NaOH与CH3COOH电离产生的H+反应,使其电离平衡向正反应方向移动;加入0.1mol/L HCl溶液,增加了溶液中的c(H+)浓度,但其平衡向逆反应方向移动;加入CH3COONa固体,增加了溶液中CH3COO―浓度,使平衡向逆反应方向移动。
答案:B