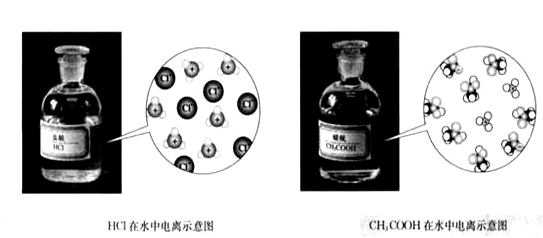
| 弱电解质的电离与电离平衡 |
主编:黄冈中学化学集体备课组
(引入)前面我们学习了电解质与非电解质,什么是电解质呢?什么是非电解质呢?
一、电解质和非电解质
1、电解质:在水溶液或熔融状态下能导电的化合物。如大多数酸、碱、盐。
2、非电解质:在水溶液或熔融状态下都不能导电的化合物。如酒精、蔗糖、大部分有机物等。
(过渡)不同的电解质电离程度并不一样。
实验:
分别试验等体积、等浓度的盐酸、醋酸溶液与等量镁条的反应;并测这两种酸的pH。
1mol/ L HCl
1 mol/ L CH3COOH
与镁条反应的现象
溶液的pH
二、强电解质和弱电解质
1、强电解质:在水溶液或熔融状态下完全电离的电解质。如强酸、强碱、大多数盐。
2、弱电解质:在水溶液或熔融状态下部分电离的电解质。如弱酸、弱碱、水。
(讲)强弱电解质是根据电离程度来区分的,而不是溶液的导电能力,有些难溶性的强电解质溶液,如BaSO4、AgCl、CaCO3等,导电能力可能比CH3COOH、NH3·H2O(aq)这些弱电解质溶液弱。电解质溶液的导电能力取决于自由自动离子的浓度与离子所带的电荷数。
(过渡)我们重点学习弱电解质的电离,比如醋酸的电离:
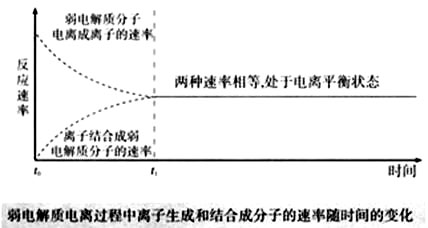
(副版)CH3COOH→H++CH3COO-,电离出来的H+与CH3COO-又会相互碰撞形成CH3COOH。因此弱电解质的电离过程是可逆的,电离方程式可写为CH3COOH
H++CH3COO-。可逆的电离过程中相反的两种趋势,最终将达到平衡状态,用v-t图可表示为:
(板书)
三、弱电解质的电离
(讲)电离平衡是一种化学平衡,也满足化学平衡的特征,同样化学平衡移动原理也适用于电离平衡。
1、弱电解质在溶液中存在电离平衡
(1)电离平衡是动态平衡:V离子化=V分子化≠0 。
(2)一定条件下达平衡时,溶液中弱电解质的分子浓度与离子浓度保持一定。
(3)条件改变,平衡会移动。
练习:已知弱电解质的电离是吸热过程,对0.1mol·L-1 CH3COOH溶液进行下列操作,完成表格。
加水
升温
加NaOH
加CH3COOH(s)
加CH3COONa
电离程度
↑
↑
↑
↓
↓
N(H+)
↑
↑
↓
↑
↓
C(H+)
↓
↑
↓
↑
↓
导电能力
减弱
增强
增强
增强
增强
(4)同一弱电解质,浓度越小,电离程度越大,但导电能力不是越强。(稀释有利于弱电解质的电离)。可以用公式推导出来这个结论。这里不讲推导过程。
(副版)CH3COOH
CH3COO-+H+加入CH3COOH(s),CH3COOH浓度增大了,电离程度减小了,但n(H+)增大。
(5)同离子效应:在弱电解质溶液中,加入与其含有相同离子的另一强电解质,对弱电解质的电离有抑制作用。同离子效应体现了浓度对电离平衡的影响。
2、电离平衡常数K
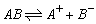
(1)对象:弱电解质
(2)K越大,弱电解质的电离程度越大,越易电离。
(3)K仅与温度有关,升高温度,K增大。(因为弱电解质的电离为吸热过程。)
但在室温范围内,可不考虑温度对电离常数的影响。
举例:CH3COOH
CH3COO-+H+ K=1.76×10-5
NH3·H2O
NH4++OH- K=1.76×10-5
同浓度的CH3COOH与NH3·H2O酸碱度相当。
(讲)多元弱酸分离电离,每一步电离都有相应的电离常数
H2CO3
H++HCO3- K1=4.3×10-7
HCO3-
H++CO32- K2=5.01×10-13
K1>K2,多元弱酸分步电离,第二步更比第一步难(前面电离出来的H+对后面的电离有抑制作用),因此多元弱酸的酸性以第一步电离出来的H+为主。
(提问)比较H2CO3、H3BO3、CH3COOH的酸性强弱。
实验:
向两支分别盛有0.1 mol/L醋酸和饱和硼酸溶液的试管中滴加等浓度Na2CO3溶液,观察现象。
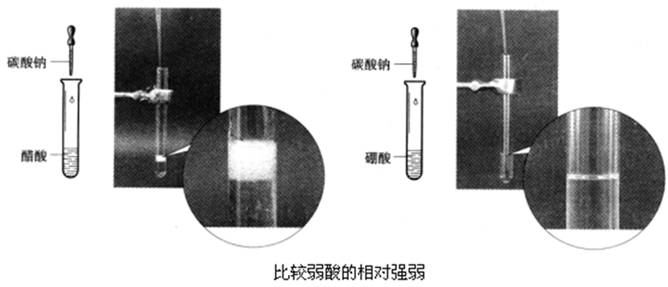
酸性:CH3COOH>H2CO3>H3BO3
醋酸、碳和硼酸的电离常数分别是1.75×10-5、4.4×10-7(第一步电离)和5.8×10-10。
通过三种酸的K值大小,也可以得出相同的结论,K值大小可以用来比较酸性强弱。
练习:H2SO3
H++HSO3 K1=1.54×10-2
H2S
H++HS- K1=5.7×10-8
HF
H++F- K=3.53×10-4
试比较H2SO3、H2S、HF、CH3COOH、H2CO3酸性
酸性:H2SO3>HF>CH3COOH>H2CO3>H2S。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -