|
一、选择题
1、某固体化合物M不导电,但在熔融状态和溶于水的情况下都能导电,下列关于M的说法中正确的是( )
A.M是非电解质 B.M是强电解质
C.M是离子化合物 D.M是共价化合物
2、关于强弱电解质及非电解质的组合完全正确的是( )
编号 |
A |
B |
C |
D |
强电解质 |
NaCl |
H2SO4 |
CaCO3 |
HClO4 |
弱电解质 |
HF |
BaSO4 |
HClO |
NH3·H2O |
非电解质 |
Cl2 |
CS2 |
C2H5OH |
H2O |
3、KHSO4在稀溶液中和熔融状态下都存在的离子是( )
A.K+ B.H+
C.SO42- D.HSO4-
4、等体积、等物质的量浓度的氢硫酸和硫酸溶液中,存在的离子总数的关系是( )
A.H2S中多 B.H2SO4中多
C.一样多 D.无法比较
5、下列反应的离子方程式或电解质电离的方程式书写正确的是( )
A.氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4
B.澄清石灰水跟盐酸反应:H++OH-=H2O
C.碳酸锁溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸在水中的电离:H2CO3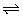 2H++CO32- 2H++CO32-
6、将0.01mol的下列物质分别加入(或通入)到100mL水中,假设溶液体积变化不计,水溶液的导电能力最强的是( )
A.HF B.NH4HCO3
C.BaSO4 D.NH3
7、有两种一元酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量CO2,发生的反应为NaR+CO2+H2O=HR+NaHCO3、2NaR′+CO2+H2O=2HR′+Na2CO3。则HR和HR′的酸性强弱比较,正确的是( )
A.HR较弱 B.HR′较弱
C.两者相差不大 D.无法比较
8、醋酸溶液中存在电离平衡:CH3COOH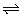 H++CH3COO-,下列叙述不正确的是( ) H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:
c(H+)=c(OH-)+c(CH3COO-)
B.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(H+)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,c(H+)=10-2mol·L-1的CH3COOH溶液与c(OH-)=10-2mol·L-1的NaOH溶液等体积混合后,两者恰和完全反应
二、填空题
9、已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O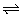 HCl+HClO;HClO HCl+HClO;HClO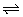 H++ClO-,达到平衡后:(1)要使HClO的浓度增大,可加入下列物质中的(填代号)__________。 H++ClO-,达到平衡后:(1)要使HClO的浓度增大,可加入下列物质中的(填代号)__________。
A.SO2 B.Na2CO3
C.HCl D.NaOH
(2)由此说明在实验室里用排饱和食盐水法收集Cl2的理由是____________________。
显示答案
|
9、(1)B
(2)由于氯水中存在下列平衡Cl2+H2O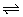 H++Cl-+HClO,而饱和食盐水中c(Cl-)很大,使平衡向左移动,使Cl2在饱和食盐水中的溶解度降低。 H++Cl-+HClO,而饱和食盐水中c(Cl-)很大,使平衡向左移动,使Cl2在饱和食盐水中的溶解度降低。 |
10、今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量相等。
a.三种溶液中c(H+)的大小关系为__________。
b.取等体积上述三种酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为____________________。
c.若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为__________。
(2)若三种酸溶液中的c(H+)相等。
a.三种酸的物质的量浓度大小关系为__________。
b.取等体积上述三种酸溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为____________________。
c.若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积的大小关系为____________________。
显示答案
|
10、(1)a.③>①>②
b.③>①=②
c.①=②>③
(2)a.②>①>③
b.②>①=③
c.①=③>② |
11、下表是几种常见弱酸的电离常数(25℃)。
酸 |
电离方程式 |
电离常数K |
CH3COOH |
CH3COOH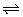 H++CH3COO- H++CH3COO- |
1.75×10-5 |
H2CO3 |
H2CO3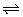 H++HCO3- H++HCO3-
HCO3-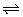 H++CO32- H++CO32- |
K1=4.4×10-7
K2=4.7×10-11 |
H2S |
H2S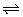 H++HS- H++HS-
HS-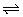 H++S2- H++S2- |
K1=1.3×10-7
K2=7.1×10-15 |
H3PO4 |
H3PO4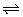 H++H2PO4- H++H2PO4-
H2PO4-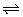 H++HPO42- H++HPO42-
HPO42-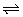 H++PO43- H++PO43- |
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13 |
回答下列问题:
(1)当温度升高时,K值__________(填“增大”“减小”或“不变”)。
(2)在相同温度时,各弱酸K值不同,那么K值的大小与酸性的相对强弱有何关系?__________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是____________________。
显示答案
|
11、(1)增大
(2)K值越大,电离出来的H+浓度越大,酸性越强
(3)H3PO4;HS-
(4)K1≥K2≥K3;上一级电离产生的H+对下一级电离有抑制作用 |
12、如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是__________,与B图变化趋势一致的是__________,与C图变化趋势一致的是__________。(填序号)
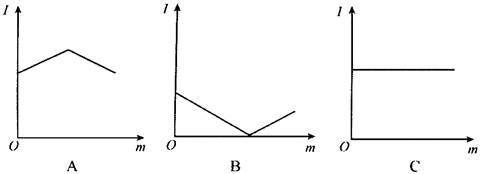
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③二氧化碳通入澄清石灰水中至过量;
④氯化铵溶液中逐渐加入适量氢氧化钠固体。
显示答案
13、在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,
不同点是______________________________,原因是____________________。
(2)a、b两支试管中生成气体的速率开始是a__________b,反应完毕生成气体的总体积是a__________b,原因是____________________。
显示答案
|
13、(1)都产生无色气泡;产生气泡的快慢程度不同,a中产生气泡快; c(H+)不同,a中c(H+)大
(2)大于;等于;开始反应时盐酸中c(H+)大,但两种酸的物质的量相等 |
14、双氧水(H2O2)和水都是极弱的电解质,但H2O2比H2O酸性强。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:________________。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成盐的化学方程式:____________________。
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为______________________________。
显示答案
|
14、(1)H2O2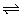 H++HO2-,HO2- H++HO2-,HO2-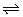 H++O22- H++O22-
(2)H2O2+Ba(OH)2=BaO2+2H2O或2H2O2+Ba(OH)2=Ba(HO2)2+2H2O
(3)H2O2+H2O2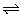 H3O2++HO2- H3O2++HO2- |
15、现有下列试剂:酚酞、石蕊、稀氨水、浓盐酸、NaOH固体、蒸馏水、CH3COONH4晶体。从以上提供的试剂中,选择恰当的试剂,设计实验证明NH3·H2O是弱碱。(已知CH3COONH4溶液呈中性)
(1)证明的理论依据是____________________。
(2)实验所需试剂____________________。
(3)简述实验步骤____________________。
(4)分析推断:由于____________________,说明____________________。从而证明NH3·H2O是弱碱。
显示答案
|
15、(1)弱碱在溶液中存在电离平衡
(2)酚酞、稀氨水、CH3COONH4晶体
(3)取适量氨水于试管中,滴加几滴酚酞,再加入适量CH3COONH4晶体,观察溶液颜色的变化
(4)溶液的红色变浅;NH3·H2O中存在电离平衡
|
|