例1、(全国卷Ⅱ)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是 ( )
( )
A.④①②⑤⑥③ B.④①②⑥⑤③
C.①④②⑥③⑤ D.①④②③⑥⑤
 解析:
解析:
①②④均属于酸,其中醋酸最强,碳酸次之,苯酚最弱。③⑤⑥均属于强碱弱酸盐,因H2CO3>苯酚>HCO3-,根据越弱越水解的原理知,对应的盐的碱性强弱为:碳酸钠>苯酚钠>碳酸氢钠,pH顺序相反,故C项正确。
答案:C
例2、(山东)某温度下,相同pH值的盐酸和酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
( )
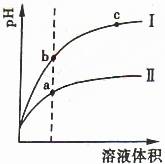
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
解析:
盐酸是强酸,醋酸是弱酸,根据弱电解质电离的特点,盐酸加水稀释比醋酸稀释的pH增大的快,故I是盐酸的,II是醋酸的,A错;b点溶液中的离子浓度大于c点,故b点的导电性强,B对;温度相同时,Kw值相同,C错;稀释相同的倍数,醋酸的浓度仍大于盐酸的浓度,所以b点酸的总浓度小于a点的总浓度,D错。
答案:B
例3、(上海)对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为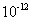 。
。
 D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
解析:
硝酸为强电解质,完全电离,稀释100倍,pH增大2,A项正确。硝酸电离出的c(H+)为0.1 mol/L,与水电离出的c(H+)为10-13 mol/L,二者之比应为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/L,故D项的比值应为1:100,D项错。
答案:AB
例4、(全国卷)将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
解析:
水的电离是一个吸热过程,升高温度平衡正向移动,氢离子和氢氧根离子浓度变大,PH变小,水的离子积变大,但是氢离子浓度与氢氧根离子浓度相等故溶液仍显中性。
答案:D
例5、(上海卷)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
解析:
等体积的0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液混合,恰好完全反应生成NaCl,溶液呈中性,pH=7;等体积的0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液混合,Ba(OH)2有剩余,溶液呈碱性,pH>7;等体积pH=4的醋酸溶液和pH=10的氢氧化钠溶液混合,CH3COOH过剩,溶液呈酸性,pH<7;等体积的pH=4的盐酸和pH=l0的氨水混合,NH3·H2O有剩余,溶液呈碱性,pH>7。
答案:BD