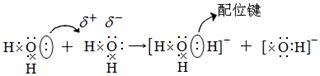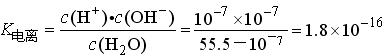| 水的电离和溶液的酸碱性 |
主编:黄冈中学化学集体备课组
(引入)电器开关上常会注明:湿手请勿触摸,水会导电。
(提问)纯水(没有任何杂质的水)能导电么?
(讲)纯水也能导电,不过导电性很弱很弱,用灵敏电流计作纯水的导电性实验,可以发现指针微弱的偏转,说明H2O会微弱的电离出自由移动的离子。
一、水的电离
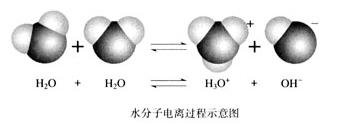
H2O+H2O
H3O++OH-
简写为H2O
H++OH-
例1、在25℃时,纯水中c(H+)=c(OH-)=10-7mol·L-1,求此时水的电离常数K电离=________。
解:
取1L水,其中
,c(H2O)=55.5mol·L-1
H2O
H+ + OH-
始(mol·L-1) 55.5 0 0
转(mol·L-1) 10-7 10-7 10-7
平(mol·L-1) 55.5-10-7 10-7 10-7
板书:c(H+)·c(OH-)=K电离·c(H2O)=KW(水的离子积常数)
温度升高,水的离子积增大。
一般在室温下,可忽略温度的影响,KW值为1.0×10-14。
(讲)水的离子积不仅适用于纯水,也适用于稀的电解质溶液。在稀溶液中水为主体,溶质很少,可近似为纯水处理。以后题目中未特殊强调说明,一般指稀溶液。常温下,纯水中c(H+)=c(OH-)=10-7mol·L-1,显中性。
(思考与交流):
根据室温时水的电离平衡,运用平衡移动原理分析下列问题。
1、酸或碱的稀溶液的密度与纯水相近,1 L酸或碱的稀溶液约为1000 g,其中H2O的物质的量近似为1000 g÷18.0 g/ mol=55.6 mol。此时,发生电离的水是否仍为纯水状态时的1.0×10-7mol?
2、比较下列情况下,c(H+)和c(OH-)的值或变化趋势(增加或减少):
纯水
加少量盐酸
加少量氢氧化钠
c(H+)
c(OH-)
c(H+)和c(OH-)
大小比较
c(H+)=c(OH-)
3、酸性溶液中是否有OH-存在?碱性溶液中是否有H+存在?试解释原因。
二、溶液的酸碱性
溶液酸碱性的实质:
中性:c(H+)=c(OH-),c(H+)=10-7mol·L-1, pH=7
酸性:c(H+)>c(OH-), c(H+)>10-7mol·L-1,pH>7
碱性:c(H+)<c(OH-), c(H+)<10-7mol·L-1, pH<7
例2、0.05mol·L-1 H2SO4溶液中,由水电离出来的c(H+)=__________。(未特殊说明即为25℃)
解析:
H2SO4 = 2H+ + SO42-
0.05 0.1
H2O
H+ + OH-
x x
∵c(H+)·c(OH-)=10-14
∴(0.1+x)·x=10-14
x=10-13 mol·L-1
例3、0.01mol·L-1 NaOH溶液中,由水电离出来的c(OH-)=__________。
解析:
c(H+)·c(OH-)=10-14
c(H+)·0.01=10-14
c(H+)=10-12mol·L-1
所以由水电离出来的c(OH-)=10-12mol·L-1 。
(讲)通过计算可知,加入了酸式碱以后,c(H+)都小于10-7mol·L-1,说明酸、碱的存在都抑制了水的电离。
练习:
1、在由水电离出的c(H+)=1×10-12mol·L-1的溶液中,一定能大量共存的离子是( )
A.K+、Fe2+、SO32-、MnO4-、H+
B.Na+、Cl-、NO3-、SO42-
C.Al3+、NH4+、Cl-、SO42-
D.Na+、AlO2-、Br-、Cl-
答案:B。
2、100℃时,水的离子积为1×10-12,若该温度下某溶液中H+浓度为1×10-7mol·L-1,则该溶液( )
A.显酸性 B.呈碱性
C.呈中性 D.c(OH-)=100c(H+)
解析:
c(H+)·c(OH-)=10-12,∴c(OH-)=10-5mol·L-1>c(H+)=1×10-7mol·L-1,显碱性。100℃,c(H+)=10-6mol·L-1时,溶液呈中性。
答案:BD。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -