1、下列溶液肯定呈酸性的是( )
A.含H+的溶液
B.能使酚酞显无色的溶液
C.pH<7的溶液
D.c(H+)>c(OH-)的溶液
2、25℃时的下列溶液中,碱性最强的是( )
A.pH=11的溶液
B.c(OH-)=0.12mol·L-1的溶液
C.1L含有4g NaOH的溶液
D.c(H+)=1×10-10mol·L-1的溶液
3、用蒸馏水稀释1mol·L-1醋酸时,始终保持增大趋势的是( )
A.溶液中c(CH3COO-)
B.溶液中c(H+)
C.溶液中c(CH3COOH)
D.溶液中c(OH-)
4、将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
5、下列说法正确的是( )
A.6mol·L-1的H2SO4溶液中存在OH-
B.因为水的离子积常数的表达式是KW=c(OH-)·c(H+),所以KW随溶液c(H+)和c(OH-)的变化而变化
C.水的电离方程式为H2O=OH-+H+
D.KW=10-14适用于任何温度、任何溶液
6、在由水电离出的c(H+)=1×10-14mol·L-1的溶液中,一定能大量共存的离子组是( )
A.K+、Fe2+、SO32-、MnO4-
B.Na+、Cl-、NO3-、SO42-
C.Al3+、NH4+、Cl-、SO42-
D.Na+、AlO2-、Br-、Cl-
7、常温下,在0.1mol·L-1 CH3COOH溶液和0.1mol·L-1 NaOH溶液中,水的电离程度( )
A.前者大 B.前者小
C.一样大 D.无法确定
8、用pH试纸测定溶液pH的正确操作是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
9、常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是( )
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④
10、25℃时,水的电离达到平衡:H2O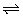 H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
11、李强同学在实验室测某溶液的pH。实验时,他先用蒸馏水湿润pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)李强的操作是__________(填“正确的”或“不正确的”),其理由是____________________。
(2)请分析上述操作是否一定有误差?______________________________。
(3)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是__________,原因是______________________________。
12、某温度下重水的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
(1)写出重水的电离方程式____________________。
(2)该温度下,重水中的c(D+)____________________,pD=__________(已知lg2=0.3)。
(3)0.01mol·L-1 NaOD溶液的pD=__________。
14、实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性强于纯水;又知液态电解质都能像水一样自身电离,而建立电离平衡(即像2H2O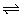 H3O++OH-),且在一定温度下都有各自的离子积常数。
H3O++OH-),且在一定温度下都有各自的离子积常数。
据此回答下列问题:
(1)纯硫酸在液态时,自身电离的电离反应方程式是____________________。它在25℃时的离子积常数K(H2SO4)比水的离子积常数K(H2O)[K(H2O)=c(H+)×c(OH-)]__________(填“大”“小”或“相等”)。
(2)在纯硫酸与纯硝酸的液态混合物中,存在的阴离子主要是__________;这是因为混合液中不但存在两种电离平衡(即H2SO4和HNO3各自的电离平衡,且硫酸的酸性强于硝酸),又在无水的条件下,混合酸中必发生__________(写离子反应方程式)反应而造成的。