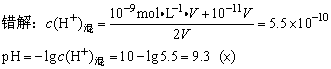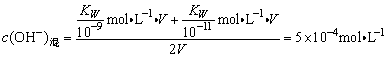| 溶液的pH与有关pH的计算 |
主编:黄冈中学化学集体备课组
一、溶液的pH
1、pH=-lg c(H+),(pOH=-lgc(OH-))
2、
3、常用公式:c(H+)·c(OH-)=1×10-14
pH+pOH=14
4、pH:0←7→14
5、pH相差一个单位,c(H+)相差10倍。
练习:pH=0 c(H+)=1mol·L-1 c(OH-)=1.0×10-14mol·L-1
pH=1 c(H+)=0.1mol·L-1 c(OH-)=10-13mol·L-1
pH=7 c(H+)=10-7mol·L-1 c(OH-)=10-7mol·L-1
pH=14 c(H+)=10-14mol·L-1 c(OH-)=1mol·L-1
练习:c(H+)=10mol·L-1 pH=-lg10=-1
c(OH-)=10mol·L-1 pOH=-lg10=-1 pH=14-(-1)=15
讲解:当c(H+)>1mol·L-1,pH<0;c(OH-)>1mol·L-1,pH>14
∴其酸碱性直接用物质的量浓度表示。(更方便些)
(讲)溶液的pH可以用pH试纸测量,也可以用pH计(酸度计)测量。
(提问)pH试纸测量溶液的pH值:
取一张试纸放在表面皿上,用洁净的玻璃棒蘸取溶液点在试纸中部,然后与标准比色卡对比,读出pH值。(注意:玻璃棒应洁净,pH试纸不能润湿)
(提问)pH试纸湿润后,溶液的pH测定有何影响?(相当于对待测溶液进行的稀释)
(提问)所测pH如何变化呢?
二、有关pH的计算
例1、等体积混合pH=2和pH=4的两种稀盐酸溶液,求混合溶液的pH=__________。
(板书有误:此处视频中c(H+)板书有误。)
例2、等体积混合pH=9和pH=11的两种NaOH溶液,求混合溶液的pH=________。
错因:碱溶液中,不能忽略H2O电离出来的c(H+)。对于碱溶液,碱电离出来的c(OH-)占多数,可以忽略H2O电离出来的c(OH-),因此先求c(OH-)混,再求c(H+)混。
正解:
pOH=-lgc(OH-)混=3.3
∴pH=14-pOH=10.7
例3、等体积混合0.1mol·L-1 HCl溶液与0.06mol·L-1 Ba(OH)2溶液,求混合溶液的pH=__________。
2HCl + Ba(OH)2 = BaCl2+2H2O
0.10 0.05<0.06
∴Ba(OH)2过量
pOH=2
∴PH=14-pOH=12
归纳:强酸与强酸混合,直接求c(H+);强碱与强碱混合,先求c(OH-)混,再求c(H+)混,强酸与强碱混合,先判断谁过量。酸过量,直接求c(H+)混,碱过量,先求c(OH-)混,再求c(H+)混。
例4、pH=4的H2SO4溶液,加水稀释10倍,pH为__________;加水稀释10000倍,pH为__________。
解:
加水稀释10倍,pH为5。
加水稀释10000倍时,酸不可能变成碱,应考虑水的电离。
H2O
H+ + OH-
10-8+x x
x(x+10-8)=10-14
x2+10-8x-10-14=0
x≈9.5×10-8
pOH=-lgc(OH-)=7.02
pH=14-pOH=6.98
总结:强酸溶液,c(H+)每稀释10n倍,pH增加n个单位,但pH<7。
强碱溶液,c(OH-)每稀释10n倍,pH减小n个单位,但pH>7。
例5、pH=4的HAc溶液稀释10倍,其pH<5。
pH=10的氨水稀释10倍,其pH>9。
(讲)弱酸、弱碱的稀释中,由于稀释过程中,电离程度增大,只能求出pH范围。
思考:一瓶盐酸,一瓶醋酸,pH相等,现有pH试纸、蒸馏水、石蕊试液、酚酞试液而没有其它试剂,简述如何用最简便的方法来判别哪瓶是强酸?
解答:取相同体积酸溶液,分别稀释100倍,用pH试纸检验,pH值改变大的是强酸,pH值改变小的是弱酸。(因为弱酸存在电离平衡,而强酸完全电离。)
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -