溶液pH的计算方法
1、酸溶液
(1)强酸溶液,如HnA,设物质的量浓度为cmol·L-1,c(H+)=ncmol·L-1,pH=-lgc(H+)=-lg(nc)。
(2)一元弱酸溶液,设物质的量浓度为cmol·L-1,电离度为α,则c(H+)=c·α,pH=-lg(Cα)。
(3)两强酸混合
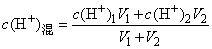 ,由c(H+)混计算pH。
,由c(H+)混计算pH。
2、碱溶液
(1)强碱溶液,如B(OH)n,设物质的量为
cmol·L-1,c(OH-)=ncmol·L-1,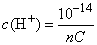 ,pH=14+lgnC。
,pH=14+lgnC。
(2)一元弱碱溶液,设物质的量浓度为cmol·L-1,电离度为α,c(OH-)=cα,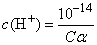 。
。
(3)两强碱混合
由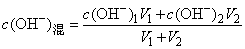 ,先求出混合后的c(OH-),再通过KW求混合后c(H+),最后求pH。
,先求出混合后的c(OH-),再通过KW求混合后c(H+),最后求pH。
3、强酸与强碱混合
先依据H++OH-=H2O,判断是否有过量的情况,可以分为下面三种情况:
(1)若恰好中和,在25℃时,pH=7;
(2)若酸过量,先求出中和后的剩余c(H+),再求pH;
(3)若碱过量,先求中和后剩余的c(OH-),再通过KW求c(H+),最后求pH。