1、95℃时,水中的H+的物质的量浓度为1×10-6mol·L-1。若把0.01mol的NaOH固体溶解于95℃水中配成1L溶液,则溶液的pH为( )
A.4 B.10
C.2 D.12
2、25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为( )
A.1010∶1 B.5×109∶1
C.108∶1 D.1∶1
3、为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,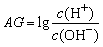 ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
4、将pH=1的盐酸平均分成两份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9∶1 B.10∶1
C.11∶1 D.12∶1
5、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则( )
A.V3>V1=V2 B.V3>V2>V1
C.V1>V2>V3 D.V3<V1=V2
6、室温时,下列溶液混合后,pH大于7的是( )
A.0.1mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸与pH=11的氨水等体积混合
D.pH=1的醋酸和0.1mol·L-1的氢氧化钠溶液等体积混合
7、pH=1的两种酸溶液A、B各1mL,加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
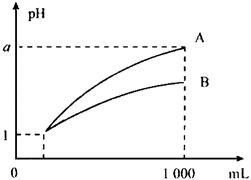
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
8、常温下,在体积均为1L pH同为2的盐酸和醋酸溶液中,分别投入0.23g金属钠,下图中符合实验事实的是( )
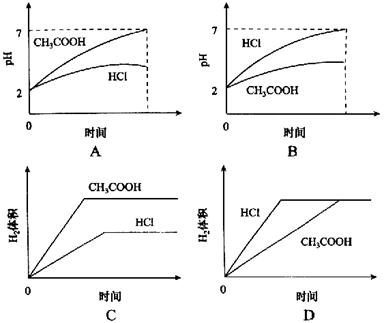
9、室温下,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
11、在某温度时,测得0.01mol·L-1的NaOH溶液的pH为11。
(1)该温度下水的离子积常数KW=__________。
(2)在此温度下,pH=a的NaOH溶液VaL,与pH=b的硫酸VbL混合。
①若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=__________;
②若所得混合溶液为中性,且a+b=12,则Va∶Vb=__________。
12、有pH=12的NaOH溶液100mL,要使它的pH降为11,
(1)若加入蒸馏水,应加__________mL。
(2)若加入pH为10的NaOH溶液,应加__________mL。
(3)若加入0.01mol·L-1的盐酸,应加__________mL。
13、已知水在25℃和95℃时,其电离平衡曲线如图所示:
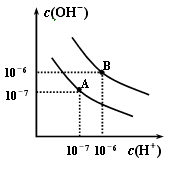
(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”),请说明理由____________________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系式是________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:______________________________。